01 Внутренняя энергия газа
Ошибка.
Попробуйте повторить позже
В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 8 раз, давление воздуха в сосуде увеличилось в 2 раза, а его абсолютная температура увеличилась в 1,5 раза. Во сколько раз уменьшилась внутренняя энергия газа в сосуде? (Воздух считать идеальным газом.)
Внутренняя энергия газа равна:
где — количество вещества газа,
— универсальная газовая постоянная,
— абсолютная температура газа,
— число
степеней свободы.
Запишем уравнение Менделеева – Клапейрона:
где — давление газа,
— объем, занимаемый газом.
Из (2) выразим и подставим в (1), получим:
Запишем (3) для первого и второго состояния с учетом того, что по условию и
:
Найдем, во сколько раз уменьшилась внутренняя энергия газа:
Таким образом, внутренняя энергия газа уменьшилась в 4 раза.
Ошибка.
Попробуйте повторить позже
Некоторое число молей одноатомного идеального газа расширяется изотермически из состояния Па и
= 1 литр до
объема
. Чему равно изменение внутренней энергии этого газа? (Ответ дайте в джоулях.)
Изменение внутренней энергии равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— изменение абсолютной температуры газа.
По условию задачи процесс изотермический, следовательно:
Подставим в формулу:
Получим, что изменение внутренней энергии также равно нулю:
Ошибка.
Попробуйте повторить позже
В процессе адиабатного сжатия двух молей идеального одноатомного газа внешние силы совершили работу 575 Дж. Определите изменение температуры данной порции газа в результате этого процесса. (Ответ дайте в кельвинах и округлите до целых).
При адиабатном процессе количество теплоты равно нулю: .
Запишем первое начало термодинамики:
где — изменение внутренней энергии газа,
— работа газа.
Для адиабатного процесса имеем:
Работа внешних сил равна:
С учетом этого получаем, что:
Изменение внутренней энергии газа равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— изменение абсолютной температуры газа,
— число степеней свободы (так как газ одноатомный, то
).
Приравняем (1) и (2) и выразим изменение температуры газа:
Ошибка.
Попробуйте повторить позже
Во сколько раз изменяется внутренняя энергия идеального газа при повышении его температуры в 2 раза при неизменном объеме?
Изменение внутренней энергии газа равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— абсолютная температура газа,
— число
степеней свободы.
Изменение внутренней энергии газа прямо пропорционально изменению его температуры. Так как температура газа увеличилась в 2
раза, то и внутренняя энергия газа изменилась в 2 раза.
Ошибка.
Попробуйте повторить позже
Один моль аргона, находящийся в цилиндре при температуре К и давлении
Па, расширяется и одновременно
охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа
Па. Чему равна внутренняя энергия газа после расширения? (Ответ дайте в джоулях и округлите до
целых.)
По условию температура газа при расширении обратно пропорциональна объёму:
Тогда справедливо следующее отношение:
Запишем уравнение Менделеева – Клапейрона для двух случаев (до расширения газа и после):
Разделим (3) на (2):
Подставим (1) в (4) и выразим температуру газа после расширения:
Найдем внутреннюю энергию газа после расширения:
Ошибка.
Попробуйте повторить позже
На -диаграмме показан процесс изменения состояния 1 моль одноатомного идеального газа. Газ в этом процессе совершил
работу, равную 4 кДж. На сколько увеличилась внутренняя энергия газа? Ответ дайте в кДж.
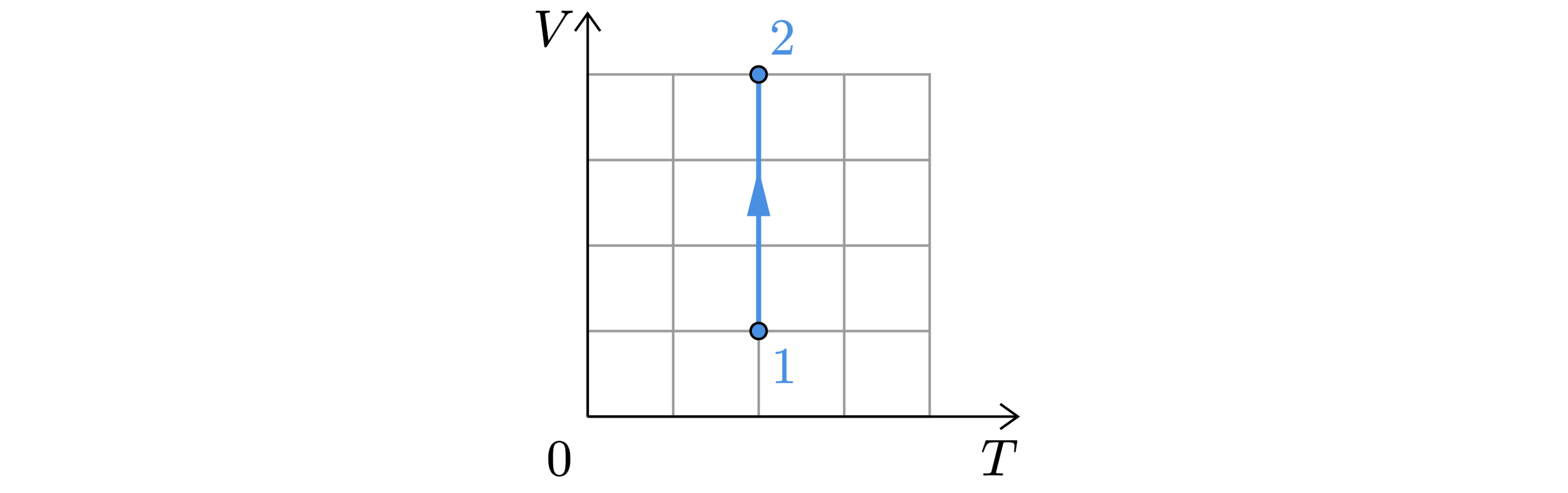
Изменение внутренней энергии равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— изменение абсолютной температуры газа.
То есть изменение равно нулю.
Ошибка.
Попробуйте повторить позже
На -диаграмме показан процесс изменения состояния 4 моль идеального одноатомного газа. Газ отдал в окружающую среду
количество теплоты, равное 2,5 кДж. На сколько уменьшилась внутренняя энергия газа в этом процессе? Ответ дайте в
кДж.
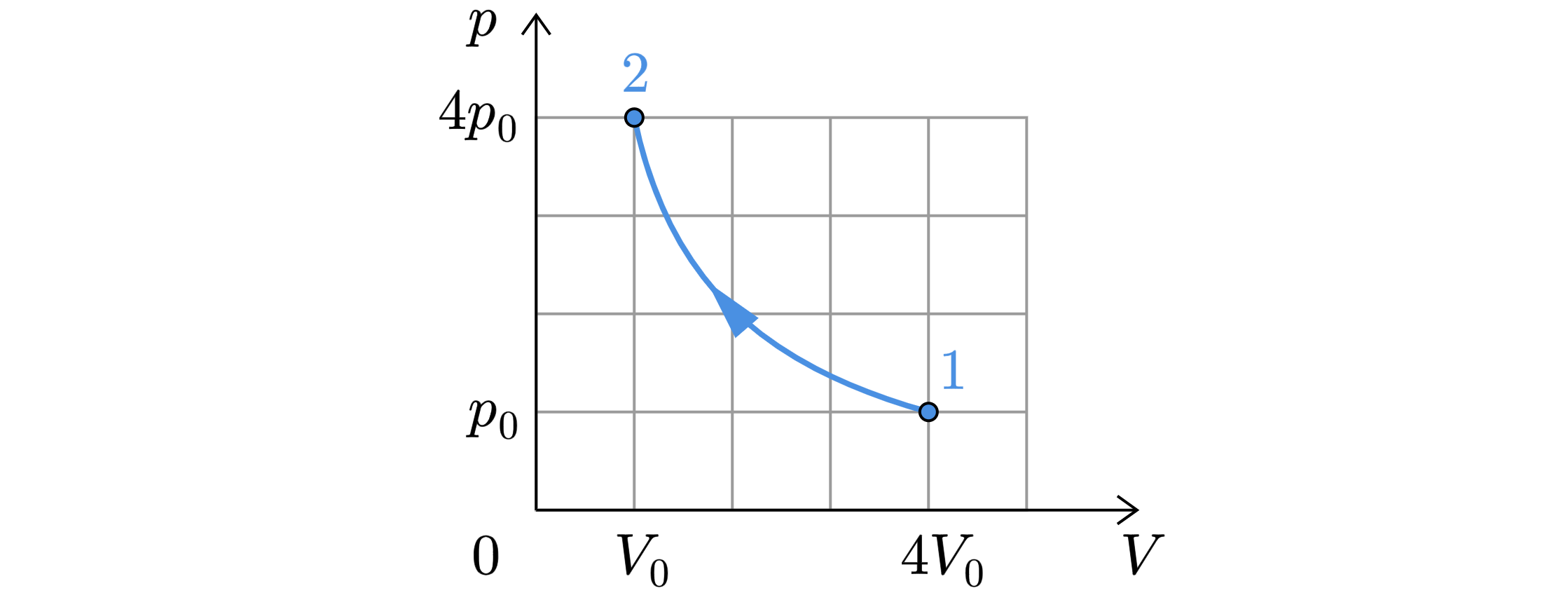
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Для точки 1
Для точки 2
откуда . Изменение внутренней энергии равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— изменение абсолютной температуры газа.
То есть изменение равно нулю.



