21. Гидролиз солей. рН водных растворов солей, кислот, щелочей
Готовиться с нами - ЛЕГКО!
Ошибка.
Попробуйте повторить позже
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HClO4
2) Ca(NO3)2
3) K2CO3
4) Fe2(SO4)3
Запишите номера веществ в порядке увеличения значения pH их водных растворов.
1) Хлорная кислота имеет сильно кислое значение рН.
2) Нитрат кальция образован сильной кислотой и сильным гидроксидом, рН нейтральная.
3) Карбонат калия образован слабой кислотой и сильным основанием, рН щелочная.
4) Сульфат железа(III) образован сильной кислотой и слабым основанием, рН кислая.
Таким образом, правильный ответ: 1423
Ошибка.
Попробуйте повторить позже
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Нитрат аммония
2) Нитрит бария
3) Нитрат кальция
4) Гидроксид азота (V)
Запишите номера веществ в порядке возрастания значения рН их водных растворов.
1) Нитрат аммония образован слабым основанием и сильной кислотой. Следовательно, среда раствора кислая.
2) Нитрит бария образован сильным основанием и слабой кислотой. Значит среда раствора - щелочная.
3) Нитрат Кальция образован сильным основанием и сильной кислотой. Среда образованного раствора нейтральная.
4) Гидроксид азота (V) - азотная кислота, имеющая кислую среду.
Расположим ответы в порядке возрастания: 4132
Ошибка.
Попробуйте повторить позже
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Перхлорат стронция
2) Сернистая кислота
3) Карбонат натрия
4) Сульфат меди (II)
Запишите номера в порядке возрастания значения рН их водных растворов.
1) Перхлорат стронция образован сильной кислотой и сильным основанием - среда образованного раствора нейтральная.
2) Сернистая кислота имеет крайне низкую рН, что свидетельствует о кислой среде.
3) Карбонат натрия образован сильным основанием и слабой кислотой - среда раствора щелочная.
4) Сульфат меди образован слабым основанием и сильной кислотой - среда раствора кислая.
Располагаем вещества в порядке возрастания: 2413
Ошибка.
Попробуйте повторить позже
Вещества, приведённые в перечне, растворили в воде и получили растворы с одинаковой молярной (моль/л) концентрацией веществ. Определите характер среды полученных растворов.
1) SO3
2) КClO2
3) NH4Cr(SO4)2*12H2O
4) CH3-CH2-OK
Запишите номера веществ в порядке возрастания значения рН растворов, полученных при внесении данных веществ в воду.

1) Здесь представлен кислотный оксид серы, при его взаимодействии с водой образуется серная кислота, то есть получается сильно кислая среда.
2) Хлорит калия образован сильным основанием и слабой кислотой. Следовательно, среда раствора щелочная.
3) В данном случае представлен кристаллогидрат. Данная соль образована двумя катионами: (гидроксид аммония и гидроксид хрома (III) ), они оба слабые. Кислота, образующая соль - сильная. Значит среда раствора кислая.
4) Этилат калия в результате гидролиза раскладывается на этанол (спирт) и сильное основание. Следовательно, среда образованного растора - щелочная.
Расположим ответы в порядке возрастания: 1324
Ошибка.
Попробуйте повторить позже
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Хлорат стронция
2) Хлорноватая кислота
3) Фенолят натрия
4) Бутановая кислота
Запишите номера в порядке убывания значения рН их водных растворов.
 1) Хлорат стронция образован сильным основанием и сильной кислотой - среда раствора нейтральная.
1) Хлорат стронция образован сильным основанием и сильной кислотой - среда раствора нейтральная.
2) Хлорноватая кислота имеет сильно кислое значение рН.
3) Фенолят натрия образован фенолом (Карболовая кислота - слабая) и сильным основанием - среда раствора щелочная.
4) Бутановая кислота - органическая кислота имеющая слабо кислую среду.
Расположим ответы в порядке убывания: 3142
Ошибка.
Попробуйте повторить позже
Вещества, приведённые в перечне, растворили в воде и получили растворы с одинаковой молярной (моль/м) концентрацией веществ. Определите характер среды полученных растворов.
1) Рубидия хлорид
2) Оксид азота (III)
3) Бензоат калия
4) Метилат натрия
Запишите номера веществ в порядке убывания значения рН растворов, полученных при внесении данных веществ в воду.
 1) Хлорид рубидия образован сильным основанием и сильной кислотой - среда раствора нейтральная.
1) Хлорид рубидия образован сильным основанием и сильной кислотой - среда раствора нейтральная.
2) Данный оксид является кислотным и при взаимодействии с водой образует слабую Азотистую кислоту, среда раствора слабо кислая.
3) Данное вещество образовано слабой Бензойной кислотой и сильным основанием. Среда раствора щелочная.
4) Метилат натрия образован сильным основанием и слабым метанолом - среда раствора щелочная, но углеродная цепь короче, поэтому она будет менее щелочной по сравнению с бензоатом калия
Расположим ответы в порядке убывания: 3412
Ошибка.
Попробуйте повторить позже
Для выполнения задания 21 используйте следующие справочные данные.

Для веществ, приведенных в перечне, определите среду их водных растворов с одинаковой концентрацией (моль/л):
1) CrCl2
2) CrCl3
3) KHCO3
4) LiOH
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Источники:
1) CrCl2- соль, образованная слабым основание и сильной кислотой, гидролиз идет по катиону, среда слабокислая pH<7
2) CrCl3- соль, образованная слабым основание и сильной кислотой, гидролиз идет по катиону, среда слабокислая pH<7, меньше, чем у CrCl2
3) KHCO3- кислая соль, но имеет слабощелочную среду,, гидролиз идет по аниону
4) LiOH- щелочь, pH>>7
Правильная последовательность: 2134
Ошибка.
Попробуйте повторить позже
 Для веществ, приведенных в перечне, определите среду их водных растворов с одинаковой концентрацией (моль/л):
Для веществ, приведенных в перечне, определите среду их водных растворов с одинаковой концентрацией (моль/л):
1) CaCl2
2) FeCl2
3) RbOH
4) NaHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Источники:
-
FeCl2 (2) — соль слабого основания (Fe(OH)2) и сильной кислоты (HCl). Гидролиз по катиону железа, среда кислая (pH < 7).
-
CaCl2 (1) — соль сильного основания (Ca(OH)2) и сильной кислоты (HCl). Гидролиз отсутствует, среда нейтральная (pH ≈ 7).
-
NaHCO3 (4) — соль слабой кислоты (H2CO3) и сильного основания (NaOH). Гидролиз по аниону HCO3-, среда слабощелочная (pH > 7).
-
RbOH (3) — сильное основание, полностью диссоциирует, среда сильнощелочная (pH ≫ 7).
Порядок возрастания pH:
FeCl2 (2) → CaCl2 (1) → NaHCO3 (4) → RbOH (3)
Правильный ответ: 2143
Ошибка.
Попробуйте повторить позже
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
рН («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов.
- Fe(NO3)3
- HCl
- KClO4
- KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация веществ во всех растворах (моль/л) одинаковая.
Источники:
- Проанализируем каждое вещество из списка:
Помните: среда при гидролизе соли определяется по сильному, а гидролиз по слабому!

- Расположим все вещества с учетом их pH в порядке возрастания:
HCl < Fe(NO3)3 < KClO4 < KHCO3
- Запишем ответ.
Ошибка.
Попробуйте повторить позже
 Для веществ, приведенных в перечне, определите характер среды их водных растворов.
Для веществ, приведенных в перечне, определите характер среды их водных растворов.
1) CH3COOH
2) K3PO4
3) HNO3
4) LiOH
Запишите номера веществ в порядке убывания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
1) CH3COOH - cлабая кислота, среда кислая, уровень pH<<7
2) K3PO4 - соль, образованная слабой кислотой и сильным основанием, гидролиз по аниону, среда слабощелочная, pH>7
3) HNO3 - сильная кислота, среда кислая, pH<<<7
4) LiOH - основание, среда щелочная, pH>>7
Правильная последовательность: 4213
Ошибка.
Попробуйте повторить позже
 Для веществ, приведенных в перечне, определите характер среды их водных растворов.
Для веществ, приведенных в перечне, определите характер среды их водных растворов.
1) K3PO4
2) H2SO4
3) Pb(NO3)2
4) KClO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
1) K3PO4 - соль , образованная основанием и слабой кислотой, гидролиз по аниону, среда слабощелочная pH>7
2) H2SO4 - сильная кислота, среда сильнокислая pH<<7
3) Pb(NO3)2 - соль , образованная слабым основанием и сильной кислотой, гидролиз по катиону, среда слабокислая pH<7
4) KClO3 - соль , образованная сильным основанием и сильной кислотой, гидролиз не идет, среда нейтральная pH=7
Правильная последовательность: 2341
Ошибка.
Попробуйте повторить позже
 Для веществ, приведенных в перечне, определите среду их водных растворов с одинаковой концентрацией (моль/л):
Для веществ, приведенных в перечне, определите среду их водных растворов с одинаковой концентрацией (моль/л):
1) NH4NO3
2) CH3COONa
3) KOH
4) HBr
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Источники:
1) NH4NO3 (нитрат аммония)- это соль, образованная слабым основанием (NH3) и сильной кислотой (HNO3). В водном растворе происходит гидролиз по катиону NH4+, что приводит к образованию слабокислой среды. Среда: кислая (pH < 7).
2) CH3COONa (ацетат натрия)- соль, образованная сильным основанием (NaOH) и слабой кислотой (CH3COOH). В водном растворе происходит гидролиз по аниону CH3COO⁻, что приводит к образованию слабощелочной среды. Среда: слабощелочная (pH > 7).
3) KOH (гидроксид калия) -это сильное основание, которое полностью диссоциирует в воде, образуя ионы K⁺ и OH⁻. Среда: сильнощелочная (pH >> 7).
4) HBr (бромоводородная кислота)- это сильная кислота, которая полностью диссоциирует в воде, образуя ионы H⁺ и Br⁻.Среда: сильно кислая (pH << 7).
- HBr (сильно кислая среда, минимальный pH).
- NH4NO3(слабокислая среда).
- CH3COONa (слабощелочная среда).
- KOH (сильнощелочная среда, максимальный pH).
Правильный ответ: 4123
Ошибка.
Попробуйте повторить позже
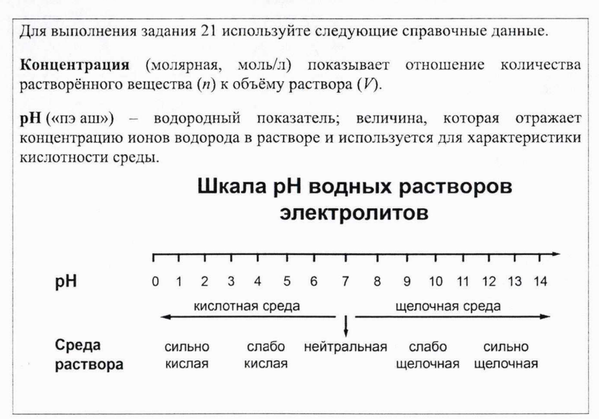
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) КНСО3
2) Ва(ОН)2
3) Cr(NO3)3
4) Li2SO4
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация веществ во всех растворах (моль/л) одинаковая.
Источники:
1) КНСО3 - соль , образованная сильным основанием и слабой кислотой, гидролиз идет по аниону. Среда слабощелочная, pH>7
2) Ва(ОН)2 - сильное основание, pH>>7
3) Cr(NO3)3 - соль, образованная слабым основанием и сильной кислотой, гидролиз по катиону, среда слабокислая , pH<7
4) Li2SO4 - соль, образованная сильным основанием и сильной кислотой, гидролиз не идет, среда нейтральная, pH=7
Расположим вещества в порядке возрастания значения рН:
Cr(NO3)3 - Li2SO4 - КНСО3 - Ва(ОН)2
Правильный ответ: 3412
Ошибка.
Попробуйте повторить позже

Для веществ, приведенных в перечне, определите характер среды их водных растворов.
1) NaClO3
2) KClO
3) (NH4)2SO4
4) HI
Запишите номера веществ в порядке убывания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
- NaClO3 (натрий хлорат)
- Это соль, образованная от сильной кислоты (HClO3) и сильного основания (NaOH), среда раствора будет нейтральным.
- KClO (калий хлорит)
- Это соль, образованная от слабой кислоты (HClO) и сильного основания (KOH), среда раствора будет щелочным.
- (NH4)2SO4 (сульфат аммония)
- Это соль, образованная от слабого основания (NH3) и сильной кислоты (H2SO4),среда раствора будет кислым.
- HI (водород йодид)
- Это сильная кислота, поэтому водный раствор будет кислым.
Теперь упорядочим вещества в порядке убывания значения pH их водных растворов:
- KClO (щелочной) - наивысшее значение pH.
- NaClO3 (нейтральный) - среднее значение pH.
- (NH4)2SO4 (кислый) - низкое значение pH.
- HI (кислый) - самое низкое значение pH.
Правильный ответ: 2134
Ошибка.
Попробуйте повторить позже
 Для веществ, приведённых в перечне, определите характер среды их водных растворов.
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) NH4NO3
2) CH3COOK
3) BaCl2
4) RbOH
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
- NH4NO3 (нитрат аммония) - это соль, образованная слабым основанием и сильной кислоты , гидролиз идет по катиону, среда слабокислая (pH<7)
- CH3COOK (ацетат калия) - это соль, образованная от сильным основанием и слабой кислоты. гидролиз идет по аниону, среда слабощелочная, (pH>7)
- BaCl2 (хлорид бария) - это соль, образованная сильным основанием и сильной кислотой, гидролиз не идет, среда нейтральная (pH=7)
- RbOH (гидроксид рубидия) - это сильное основание, среда сильщелочная (pH>>7)
Расположим вещества в порядке увеличения pН
NH4NO3 > BaCl2 > CH3COOK > RbOH
Правильный ответ: 1324
Ошибка.
Попробуйте повторить позже

Для веществ, приведенных в перечне, определите характер среды их водных растворов.
1) Cr(NO3)3
2) Ca(OH)2
3) CH3COONH4
4) HClO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
1) Cr(NO3)3 -соль, образованная слабым основание и сильной кислотой, гидролиз идёт по катиону, среда слабокислая, pH<7
2) Ca(OH)2- основание, среда щелочная,pH>>>7
3) CH3COONH4 - соль, образованная слабым основание и слабой кислотой, гидролиз не идёт, среда нейтральная ,pH=7
4) HClO4-кислота, среда кислая, pH<<<7
Запишем номера веществ в порядке возрастания значения pH их водных растворов:
НClO4 < Cr(NO3)3 < CH3COONH4 < Са(ОН)2
Правильный ответ: 4312
Ошибка.
Попробуйте повторить позже
 Для веществ, приведённых в перечне, определите характер среды их водных растворов.
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) бромид хрома(III)
2) ацетат калия
3) иодоводород
4) нитрат лития
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
1) Бромид хрома(III) (CrBr3):
- Хром(III) — это катион слабого основания (гидроксид хрома(III) Cr(OH)3 слабо растворим и слабо диссоциирует).
- Бромид-ион (Br-) — это анион сильной кислоты (HBr), который не гидролизуется.
- В результате гидролиза катиона Cr3+ раствор будет иметь кислую среду (pH < 7).
2) Ацетат калия (CH3COOK):
- Ацетат-ион (CH3COO-) — это анион слабой кислоты (уксусной кислоты CH3COOH), который гидролизуется, образуя щелочную среду.
- Калий (K+) — это катион сильного основания (KOH), который не гидролизуется.
- В результате гидролиза ацетат-иона раствор будет иметь щелочную среду (pH > 7).
3) Иодоводород (HI):
- HI — это сильная кислота, которая полностью диссоциирует в воде.
- Раствор будет иметь сильнокислую среду (pH « 7).
4) Нитрат лития (LiNO3):
- Нитрат-ион (NO3-) — это анион сильной кислоты (HNO3), который не гидролизуется.
- Литий (Li+) — это катион сильного основания (LiOH), который не гидролизуется.
- Раствор будет нейтральным (pH ≈ 7).
Теперь запишем номера веществ в порядке возрастания pH их растворов:
1. Иодоводород (HI) — сильнокислая среда (наименьший pH).
2. Бромид хрома(III) (CrBr3) — слабокислая среда.
3. Нитрат лития (LiNO3) — нейтральная среда.
4. Ацетат калия (CH3COOK) — слабощелочная среда (наибольший pH).
Правильный ответ: 3142
Ошибка.
Попробуйте повторить позже

Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) уксусная кислота
2) метиламин
3) азотная кислота
4) гидроксид кальция
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
Определим характер среды и pH для каждого вещества:
-
Уксусная кислота (CH3COOH):
-
Слабая кислота, pH < 7.
-
-
Метиламин (CH3NH2):
-
Слабое основание, pH > 7.
-
-
Азотная кислота (HNO3):
-
Сильная кислота, pH << 7.
-
-
Гидроксид кальция (Ca(OH)2:
-
Сильное основание, pH >> 7.
-
Порядок веществ по возрастанию pH:
-
Азотная кислота (самая низкая pH, сильная кислота).
-
Уксусная кислота (слабая кислота, pH выше, чем у азотной кислоты).
-
Метиламин (слабое основание, pH > 7).
-
Гидроксид кальция (самое высокое pH, сильное основание).
Правильный ответ: 3124
Ошибка.
Попробуйте повторить позже
 Для веществ, приведённых в перечне, определите характер среды их водных растворов.
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) NH4Br
2) HI
3) Na2SiO3
4) KClO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
Для определения порядка веществ по возрастанию pH их водных растворов, рассмотрим характер среды каждого вещества:
1) NH4Br
- NH4Br — соль, образованная слабым основанием (NH4OH) и сильной кислотой (HBr).
- В водном растворе гидролизуется по катиону, образуя кислую среду (pH < 7).
2) HI
- HI — сильная кислота.
- В водном растворе полностью диссоциирует, создавая кислую среду (pH < 7).
- Кислотность HI выше, чем у NH4Br, так как это сильная кислота.
3) Na2SiО3
- Na2SiO3— соль, образованная сильным основанием (NaOH) и слабой кислотой (H2SiO3).
- В водном растворе гидролизуется по аниону, образуя щелочную среду (pH > 7).
4) KClO4
- KClO4 — соль, образованная сильным основанием (KOH) и сильной кислотой (HClO4).
- В водном растворе не гидролизуется, среда нейтральная (pH = 7).
Правильный ответ: 2143
Ошибка.
Попробуйте повторить позже
 Для веществ, приведённых в перечне, определите характер среды их водных растворов.
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) H3PO4
3) Ba(NO3)2
4) Ca(OH)2
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Источники:
-
H3PO4 (фосфорная кислота):
Кислая среда (pH < 7). Диссоциирует с выделением H+. -
Ba(NO3)2 (нитрат бария):
Нейтральная среда (pH ≈ 7). Соль сильного основания (Ba(OH)2) и сильной кислоты (HNO3), гидролиз отсутствует. -
Na2CO3 (карбонат натрия):
Щелочная среда (pH > 7). Гидролиз по аниону. -
Ca(OH)2 (гидроксид кальция):
Сильнощелочная среда (pH ≫ 7). Сильное основание, диссоциирует полностью.
2) H3PO4 → 3) Ba(NO3)2 → 1) Na2CO3 → 4) Ca(OH)2
Правильный ответ: 2314



