03 Первое начало термодинамики
Ошибка.
Попробуйте повторить позже
В цилиндр с подвижным поршнем накачали моля идеального одноатомного газа при температуре
. Накачивание
вели так, что давление газа было постоянным. Затем накачку прекратили и дали газу в цилиндре расшириться без теплообмена с
окружающей средой до давления
атм. При этом газ остыл до температуры
. Какую суммарную работу совершил
газ в этих двух процессах? В исходном состоянии цилиндр был пуст и поршень касался дна. (Ответ дайте в кДж округлите до
целых.)
В первом процессе газ расширяется при постоянном давлении от объема 0 до . Так как
, то процесс изобарный и
работу газа, совершенную за этот процесс можно найти по формуле:
Запишем уравнение Менделеева – Клапейрона:
где — количество вещества газа,
— универсальная газовая постоянная,
.
Подставим (2) в (1):
Рассмотрим второй процесс. В условии сказано, что газ расширялся без теплообмена с окружающей средой, то есть второй
процесс был адиабатическим.
Запишем первое начало термодинамики для адиабатического процесса (с учетом того, что ):
где — количество теплоты,
— изменение внутренней энергии газа. Выразим работу газа, совершенную во втором
процессе:
Изменение внутренней энергии одноатомного газа во втором процессе равно:
где изменение абсолютной температуры газа во втором процессе , причем
.
Подставим (4) в (3):
Найдем суммарную работу, которую совершил газ в этих двух процессах:
Ошибка.
Попробуйте повторить позже
Внешними силами над идеальным одноатомным газом, количество которого равно 1,5 моля, совершена работа, равная 3600 Дж, при
этом температура газа увеличилась на 230 К. Чему равно количество теплоты , полученное газом в этом процессе? (Ответ дайте в
Дж и округлите до целого числа.)
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа.
Изменение внутренней энергии газа равно:
где — количество вещества газа,
— универсальная газовая постоянная,
— изменение абсолютной температуры газа,
— число степеней свободы (так как газ одноатомный, то
).
Подставим (2) в (1):
Работа внешних сил равна:
С учетом этого получаем, что:
Подставим известные значения (с учетом того, что изменение температуры в градусах Цельсия и Кельвина одинаково):
Ошибка.
Попробуйте повторить позже
Идеальный газ получил количество теплоты 300 Дж и при этом внутренняя энергия газа увеличилась на 100 Дж. Какова работа, совершенная газом? (Ответ дайте в джоулях.)
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Выразим работу
газа:
Ошибка.
Попробуйте повторить позже
Идеальный газ получил количество теплоты 100 Дж и при этом внутренняя энергия газа уменьшилась на 100 Дж. Какова работа, совершенная газом? (Ответ дайте в джоулях.)
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Выразим работу
газа:
Ошибка.
Попробуйте повторить позже
В некотором процессе газ отдал окружающей среде количество теплоты, равное 10 кДж. При этом внутренняя энергия газа увеличилась на 30 кДж. Определите работу, которую совершили внешние силы, сжав газ. Ответ выразите в кДж.
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Выразим отсюда работу
газа:
Работа внешних сил над газом равна:
Подставим (2) в (1) и выразим работу внешних сил:
Ошибка.
Попробуйте повторить позже
В некотором процессе газ отдал окружающей среде количество теплоты, равное 10 кДж. При этом внутренняя энергия газа увеличилась на 30 кДж. Определите работу, которую совершили внешние силы, сжав газ. Ответ дайте в кДж.
Источники:
По первому закону Термодинамики:
где – переданное количество теплоты,
– изменение внутренней энергии,
– работа над газом.
Ошибка.
Попробуйте повторить позже
На ТV – диаграмме показан процесс изменения состояния идеального одноатомного газа. Газ получил количество теплоты, равное 50 кДж. Какую работу совершил газ в этом процессе, если его масса не меняется? Ответ дайте в кДж.
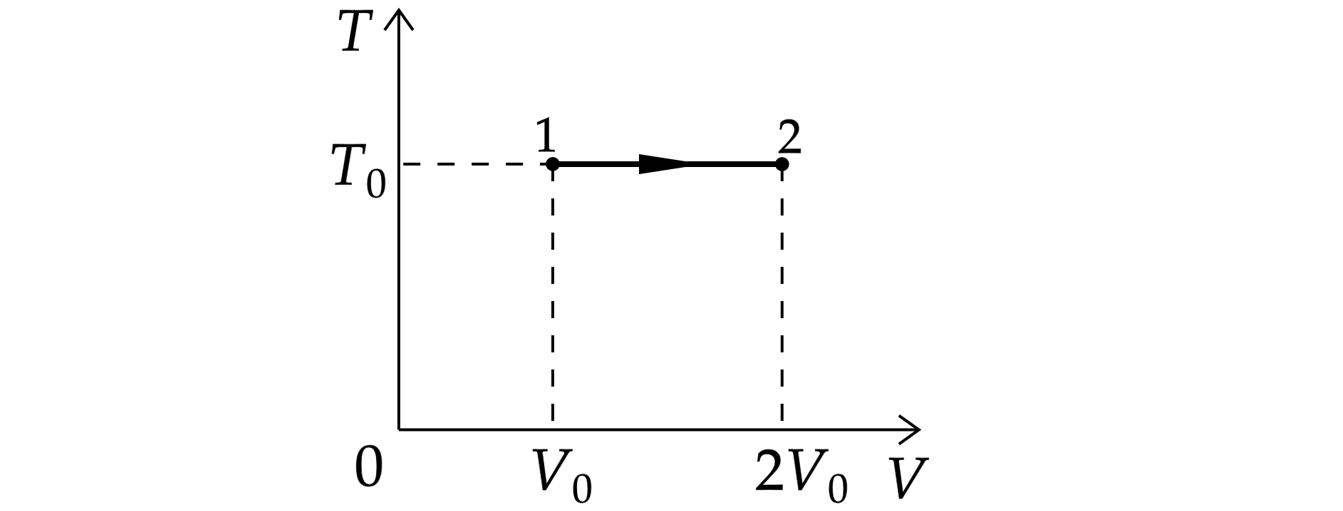
Источники:
Из первого начала термодинамики для изотермического процесса(изменение внутренней энергии равно 0)
Ошибка.
Попробуйте повторить позже
На рисунке показан циклический процесс изменения состояния постоянной массы одноатомного идеального газа. На каком участке работа внешних сил над газом положительна и равна отданному газом количеству теплоты
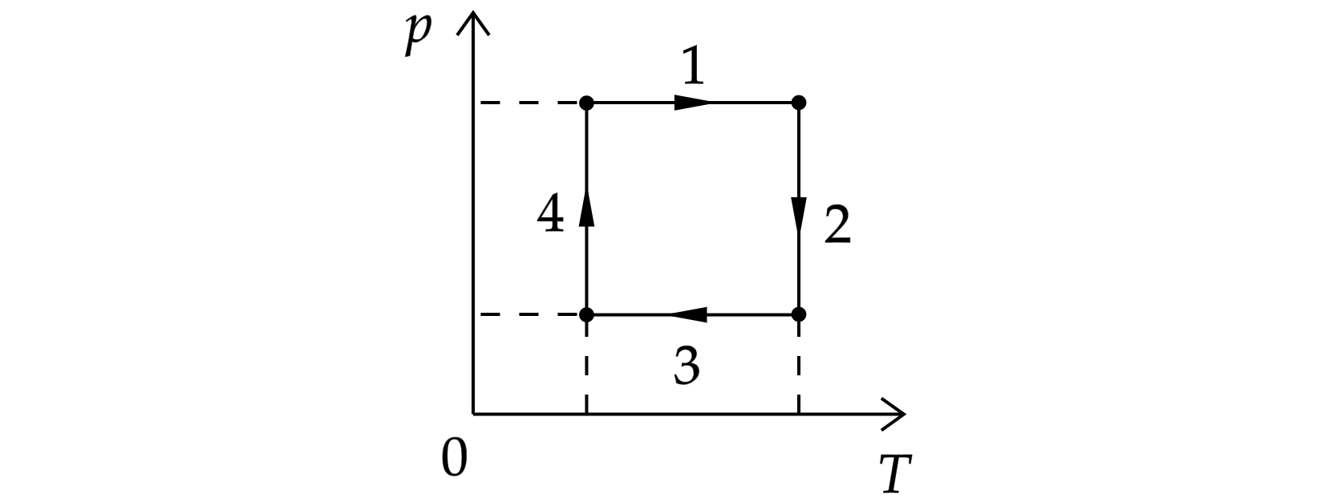
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Так как , то
, при этом изменение внутренней энергии равно:
где – количество вещества,
– изменение температуры.
Следовательно, температура не изменялась.
Работа газа отрицательна, если объём газа уменьшается. По закону Бойля-Мариотта:
где – объём, то есть объём уменьшается при увеличении давления, что соответствует графику 4.
Ошибка.
Попробуйте повторить позже
В процессе эксперимента внутренняя энергия газа увеличилась на Дж, при этом газ отдал окружающей среде количество
теплоты, равное
Дж. Какую работу совершили над газом внешние силы в данном эксперименте? Ответ дать в
Дж.
По первому закону термодинамики:
где — количество теплоты (т.к. по условию газ отдает количество теплоты, то при подстановке значений мы
будем писать его со знаком "
"),
— изменение внутренней энергии газа, а
— работа, совершенная газом.
Отсюда:
Известно, что:
где — работа внешних сил над газом. Подставим сюда (1) и выразим
:
Ошибка.
Попробуйте повторить позже
На -диаграмме показан процесс изменения состояния постоянной массы идеального газа. В этом процессе газ совершает работу,
равную 3 кДж. Каково количество теплоты, полученное газом? (Ответ дайте в кДж.)
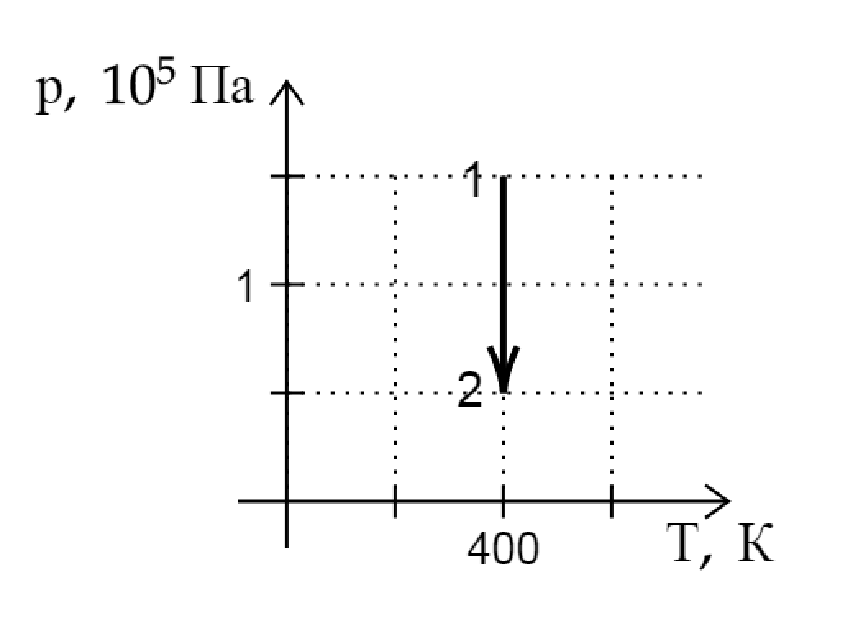
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа, совершенная
газом.
По графику находим, что , значит
. Подставим это в (1):
Ошибка.
Попробуйте повторить позже
В процессе адиабатного сжатия над 2 молями идеального одноатомного газа совершают
работу 997,2 Дж. Определите модуль изменения температуры данной порции газа в результате этого
процесса. Универсальную газовую постоянную принять Ответ дайте в
К.
По первому закону термодинамики:
В адиабатном процессе газ не получает теплоты от внешней среды:
Отсюда:
Ошибка.
Попробуйте повторить позже
Идеальный газ совершил работу 161 кДж и при этом внутренняя энергия газа уменьшилась на 140 кДж. Какое количество теплоты получил газ в этом процессе? (Ответ дать в кДж)
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа, совершенная
газом.
Ошибка.
Попробуйте повторить позже
На рисунке показан график изменения состояния постоянной массы идеального газа. В этом процессе газ отдал количество теплоты, равное 4 кДж. На сколько уменьшилась внутренняя энергия газа? Ответ дайте в кДж.
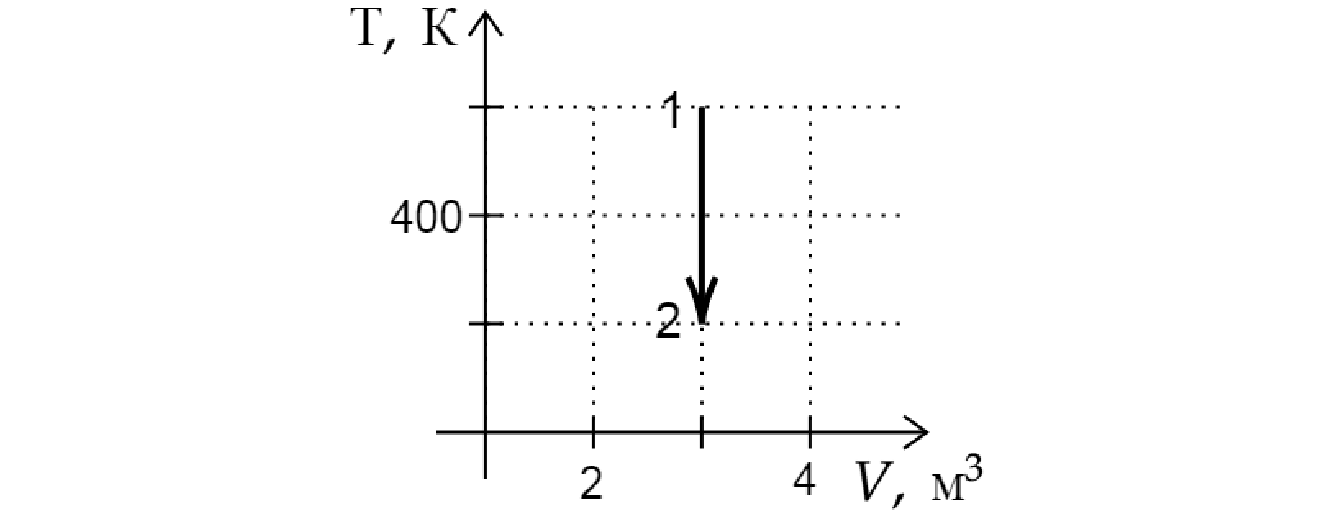
Из графика видно, что данный процесс является изохорным. Поскольку объем газа не изменялся, газ не совершал работы. Следовательно, согласно первому началу термодинамики:
Ошибка.
Попробуйте повторить позже
В некотором процессе газ получает количество теплоты 97 Дж, внутренняя энергия газа увеличивается, причём изменение его внутренней энергии составляет 4/7 от работы газа. Какую работу совершает газ в этом процессе? Ответ дать в Дж и округлить до целых.
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа, совершенная газом.
По условию . Отсюда:
Ошибка.
Попробуйте повторить позже
В процессе адиабатного расширения четырех молей идеального одноатомного газа газ совершил работу 100 Дж. Определите изменение внутренней энергии газа в этом процессе. Ответ дайте в Дж.
По первому закону термодинамики:
В адиабатном процессе газ не получает теплоты от внешней среды:
Ошибка.
Попробуйте повторить позже
В некотором процессе идеальный газ совершает работу 140 Дж, причем полученное газом количество теплоты составляет 16/7 от изменения внутренней энергии газа (внутренняя энергия увеличивается). Чему равно изменение внутренней энергии газа в этом процессе? Ответ дайте в Дж и округлите до целых.
По первому закону термодинамики:
| Q = ΔU + A, |
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
—
работа, совершенная газом.
По условию . Отсюда:
|
|
|
A = |
Ошибка.
Попробуйте повторить позже
Некоторое количество идеального одноатомного газа нагреваются в плотно закрытом сосуде. Зная, что масса газа г и газ
получил количество теплоты
Дж. Определите, на сколько повысилась температура газа, если молярная масса газа равна
кг/моль. Ответ дайте в Кельвинах и и округлите до целых.
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа,
совершенная газом.
, т.к. по условию
(сосуд плотно закрыт).
Отсюда:
Осталось выразить :
Ошибка.
Попробуйте повторить позже
Внутренняя энергия газа в процессе эксперимента увеличилась на 33 кДж, при этом внешние силы совершили работу над газом, равную 51 кДж. Какое количество теплоты газ отдал окружающей среде? Ответ выразить в кДж.
По первому закону термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа, а
— работа, совершенная газом.
где — работа внешних сил над газом.
Отсюда:
Значит, газ отдал окружающей среде количество теплоты, равное 18 кДж.
Ошибка.
Попробуйте повторить позже
Внутреннюю энергию 2 молей одноатомного идеального газа уменьшили на 800 Дж, а внешние силы совершили над ним работу 400 Дж. Какое количество теплоты отдал газ? Ответ дайте в Джоулях.
Запишем первый закон термодинамики
где – изменение внутренней энергии,
– работа внешних сил.
Ошибка.
Попробуйте повторить позже
На рисунке показан циклический процесс изменения состояния постоянной массы одноатомного идеального газа. На каком участке работа газа положительна и равна полученному газом количеству теплоты
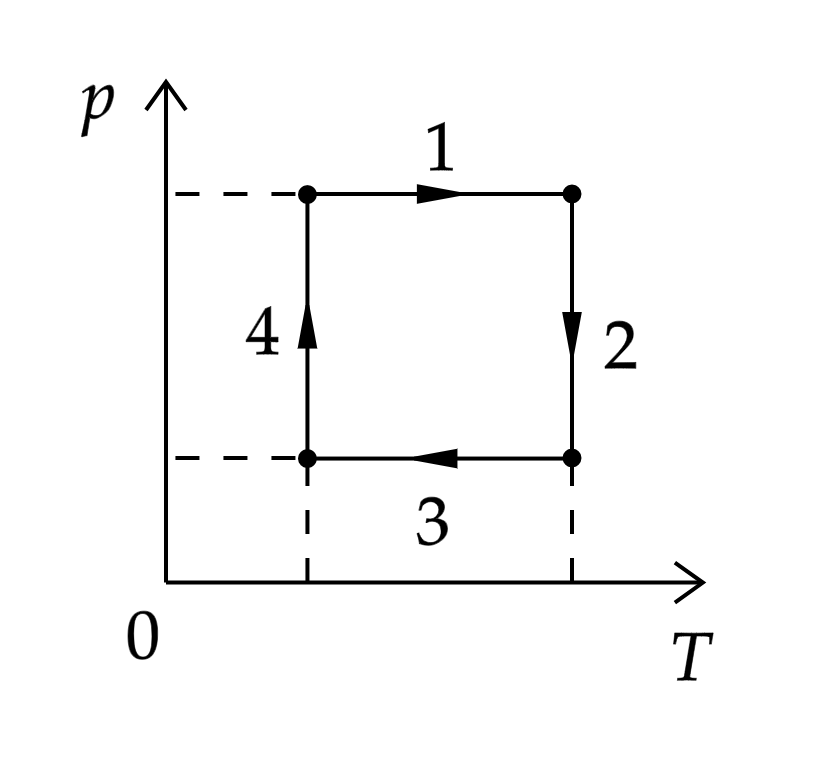
Источники:
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Так как , то
, при этом изменение внутренней энергии равно:
где – количество вещества,
– изменение температуры.
Следовательно, температура не изменялась.
Работа газа положительна, если объём газа увеличивается. По закону Бойля-Мариотта:
где – объём, то есть объём увеличивается при уменьшении давления, что соответствует графику 2.



