18. Скорость химической реакции
Готовиться с нами - ЛЕГКО!
Ошибка.
Попробуйте повторить позже
Из предложенного перечня выберите все реакции, которые при одинаковых температуре и концентрации кислот протекают с меньшей скоростью, чем взаимодействие гранул цинка с соляной кислотой.
1) взаимодействие гранул магния с соляной кислотой
2) взаимодействие гранул цинка с уксусной кислотой
3) взаимодействие порошка магния с серной кислотой
4) взаимодействие раствора гидроксида бария и соляной кислоты
5) взаимодействие гранул железа с раствором уксусной кислоты
Источники:
Ошибка.
Попробуйте повторить позже
Из предложенного перечня выберите все факторы, которые приводят к увеличению скорости химической реакции алюминия с жидким бромом.
1) использование ингибитора
2) увеличение степени измельчения алюминия
3) повышение давления в системе
4) понижение температуры
5) увеличение температуры
Источники:
Ошибка.
Попробуйте повторить позже
Источники:
Напишем уравнение взаимодействие серы с железом:
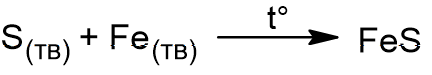
Ошибка.
Попробуйте повторить позже
Из предложенного перечня выберите уравнения всех реакций, на скорость которых влияет изменение концентрации кислоты.
- Zn + 2H+(p-p) = Zn2+ + H2
- FeO + 2HBr = FeBr2 + H2O
- PCl5 + 4H2O= 5HCl + H3PO4
- SO2 + H2O = H2SO3
- Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Источники:
- Анализ условия:
В задании необходимо выбрать уравнения всех реакций, на скорость которых влияет изменение концентрации кислоты.
Чем выше концентрация, тем быстрее идёт реакция. Чем концентрация ниже, тем, соответственно, медленнее идёт реакция.
Помним, что в этом задании мы смотрим только на ПРЯМУЮ реакцию, следовательно при решении анализируем только её. То есть нам надо выбрать все реакции, у которых в реагентах (исходных веществах) есть кислота.
- Проанализируем все предложенные уравнения реакций:
1) Zn + 2H+(p-p) = Zn2+ + H2
Здесь представлено сокращённое ионное уравнение реакции между цинком и кислотой. Так как при диссоциации кислоты в растворе образуются катионы водорода и анионы кислотного остатка, то изменение концентрации кислоты будет влиять на скорость этой реакции, потому что кислота есть в реагентах.
2) FeO + 2HBr = FeBr2 + H2O
Здесь представлено уравнение реакции между оксидом железа (II) и бромоводородной кислотой. В этой реакции изменение концентрации кислоты будет влиять на скорость этой реакции, потому что кислота есть в реагентах.
3) PCl5 + 4H2O= 5HCl + H3PO4
Здесь представлено уравнение реакции между хлоридом фосфора (V) и водой. В этой реакции изменение концентрации кислоты не будет влиять на скорость этой реакции, потому что кислоты нет в реагентах.
4) SO2 + H2O = H2SO3
Здесь представлено уравнение реакции между оксидом серы (IV) и водой. В этой реакции изменение концентрации кислоты не будет влиять на скорость этой реакции, потому что кислоты нет в реагентах.
5) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Здесь представлено уравнение реакции между гидроксидом алюминия и азотной кислотой. В этой реакции изменение концентрации кислоты будет влиять на скорость этой реакции, потому что кислота есть в реагентах.
- Анализируем решение:
Изменение концентрации кислоты будет влиять на скорость 1, 2 и 5 реакций.
- Запишем ответ.
Ошибка.
Попробуйте повторить позже
Из предложенного перечня выберите все реакции, скорость которых уменьшается при увеличении pH среды.
1) Zn + KOH + H2O → K2[Zn(OH)4] + H2
2) Zn + HCl → ZnCl2 + H2
3) NaH + HCl → NaCl + H2
4) NaH + H2O → NaOH + H2
5) CaCO3 + HNO3 → Ca(NO3)2 + CO2 + H2O
Источники:

