6.01 d-металлы и их соединения
Готовиться с нами - ЛЕГКО!
Ошибка.
Попробуйте повторить позже
В одну из пробирок с раствором хлорида меди (II)добавили вещество X и в результате наблюдали образование меди. В другую пробирку с раствором хлорида меди (II) добавили раствор Y. В результате реакции образовался голубой осадок. Из предложенного перечня выберите X и Y
1) цинк
2) гидроксид цинка
3) гидроксид калия
4) оксид цинка
5) серебро
- Задание предполагает написание двух уравнений реакций и выбора двух веществ из списка. При выполнении задания может помочь таблица растворимости и ряд активности металлов.
- Проанализируем первую пробирку: «В одну из пробирок с раствором хлорида меди (II) добавили вещество X и в результате наблюдали образование меди»
Если в результате реакции медь выпадает в осадок, то подразумевается реакция замещения с более активным металлом: АВ+С =СВ +А, где С более активный металл вытесняет менее активный металл из соли.
Из металлов в списке есть: цинк и серебро.
Посмотрим их положение в ряду активности и сравним относительно меди.
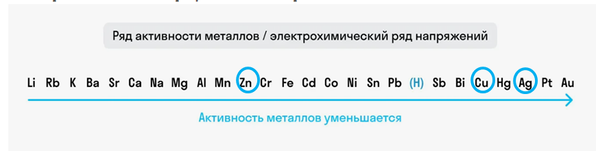
Серебро стоит правее меди, этот металл менее активный, а цинк стоит левее меди и соответсвенно является более активным и может вытеснить медь из ее соли
 (1) CuCl2 (р-р) + Zn = ZnCl2 + Cu↓
(1) CuCl2 (р-р) + Zn = ZnCl2 + Cu↓
3. Проанализируем вторую пробирку: «В другую пробирку с раствором хлорида меди (II) добавили раствор Y. В результате реакции образовался голубой осадок.»
Здесь подразумевается реакция обмена. Помним, что соли могут вступать в реакцию обмена только с растворимыми веществами. Выбираем из списка сильный электролит – гидроксид калия. Гидроксид цинка не подойдет, так как он не растворим.
 (2) CuCl2 (р-р) + 2КOH = Cu(OH)2 ↓+ 2KCl
(2) CuCl2 (р-р) + 2КOH = Cu(OH)2 ↓+ 2KCl
В результате реакции образуется голубой осадок Cu(OH)2 ↓ - гидроксид меди II

Ошибка.
Попробуйте повторить позже
Имеются две пробирки с окрашенным раствором вещества Х. При пропускании хлора через первую наблюдали образование фиолетового раствора, а при добавлении ко второй вещества Y в пробирке выпал один осадок.
1) MnSO4
2) KBr
3) K2MnO4
4) NaI
5) K2S
Источники:
Составим предварительную схему:
Х (окрашенное вещество) + Сl2 → фиолетовый раствор
Х (окрашенное вещество) + Y → выпадение одного осадка
Этой схеме соответствует:
а) 2K2MnO4 + Сl2 → 2KMnO4 + 2KCl
б) K2MnO4 + MnSO4 → K2SO4 + 2MnO2
Следовательно, X - K2MnO4, Y - MnSO4.
Ошибка.
Попробуйте повторить позже
Имеются две пробирки с раствором вещества Х. В одну из них добавили небольшое количество раствора гидроксида калия, при этом наблюдали образование белого осадка. В другую пробирку прилили раствор слабого электролита Y. При этом также наблюдали образование белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) уксусная кислота
2) хлорид железа(III)
3) фторид натрия
4) аммиак
5) сульфат алюминия
Запишите номера выбранных веществ под соответствующими буквами.
Источники:
Для начала проанализируем, с каким веществом взаимодействует гидроксид калия с образованием осадка. Взаимодействие с уксусной кислотой не дает осадка, взаимодействие с хлоридом железа (III) дает осадок бурого цвета, взаимодействие с фторидом натрия не приводит к качественным признакам реакции, с аммиаком реакция не идет, взаимодействие с сульфатом алюминия приводит к образованию белого осадка гидроксида алюминия:
Al2(SO4)3 + 6KOH(недост.)→2Al(OH)3↓ + 3K2SO4
То есть вещество X- сульфат алюминия
Далее нам нужно выбрать слабый электролит, они представлены аммиаком и уксусной кислотой. Сульфат алюминия не будет реагировать с уксусной кислотой, а тем более не будет выпадать осадок. А при взаимодействии сульфата алюминия с аммиаком будет образовываться Al(OH)3↓ осадок белого цвета:
Al2(SO4)3 + 6NH3+6H2O→2Al(OH)3↓+3(NH4)2SO4
Следовательно, вещество Y - аммиак
Правильный ответ: 54
Ошибка.
Попробуйте повторить позже
Навеска алюминия прореагировала при нагревании с веществом Х. Выделившееся вещество поглотили раствором вещества Y, в результате чего в растворе образовались две соли и простое вещество. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Едкий кали
2) Нитрат железа (III)
3) Иодид алюминия
4) Иод
5) Нитрат железа (II)
Источники:
Ошибка.
Попробуйте повторить позже
В двух колбах находился раствор карбоната калия. В первую колбу добавили раствор вещества X , а во вторую - раствор вещества Y. В обеих колбах выпал осадок, но в первой колбе также выделился газ.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) BaSO4
2) CuSO4
3) HNO3
4) AgNO3
5) NH3
Источники:
Составим предварительную схему:
K2CO3 + Х → осадок + газ
K2CO3 + Y → осадок
Этой схеме соответствует:
а) 2K2CO3 + 2CuSO4 + H2O→ (CuOH)2CO3 + 2K2SO4 + CO2
б) K2CO3 + AgNO3 → 2KNO3 + Ag2CO3
Следовательно, X - CuSO4, Y - AgNO3.
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором нитрата меди(II). В первую пробирку добавили металл X, в результате наблюдали образование красноватого налёта на его поверхности. Во вторую пробирку добавили раствор вещества Y, В этой пробирке произошла реакция, которую описывает сокращённое ионное уравнение
Cu2+ + S2- = CuS
Из предложенного перечня выберите вещества X и Y, которые участвовали в описанных реакциях.
1) железо
2) калий
3) сульфид калия
4) сероводород
5) гидросульфид калия
Источники:
Составим предварительную схему:
1) Cu(NO3)2 (р-р) + X (металл) → образование красноватого налета на поверхности металла
2) Cu(NO3)2 (р-р) + Y (р-р), этой схеме соответствует ионное уравнение: Cu2+ + S2- = CuS.
На роль X подходят только металлы, а на роль Y - жидкие/ растворимые вещества. Металлы: железо, калий. Растворимые вещества: сульфид калия, сероводород, гидросульфид калия.
Так как нитрат меди представляет из себя раствор, то взаимодействие этого раствора с калием недопустимо: калий в первую очередь будет бурно взаимодействовать с водой с образование гидроксида калия. Гидроксид калия при взаимодействии с нитратом меди образует голубой осадок гидроксида меди (II). А при реакции с железом произойдет реакция замещения. Так как в ряду напряжений металлов железо стоит левее меди, то оно сможет замещать медь из соли, образуются нитрат железа (II) и чистая медь. Медь - металл красного цвета, она и будет выделяться на поверхности железа в виде налета. Таким образом, вещество X - железо.
Следуя из ионного уравнения, нитрат меди должен прореагировать с сульфидсодержащим сильным электролитом, способным диссоциировать до сульфид-аниона. Сероводород - слабый электролит, не диссоциирует. Гидросульфид калия - сильный электролит, однако диссоциирует до катиона калия и гидросульфид-аниона, поэтому он тоже не подходит. Сульфид калия - сильный электролит, способен диссоциировать до нужного нам сульфид-аниона. Таким образом, вещество Y - сульфид калия.
Таким подбором мы выяснили, что вещество X - железо, а Y - сульфид калия. Приведем уравнения реакций для наглядного примера.
Этой схеме могут соответствовать следующие реакции:
1) Fe + Cu(NO3)2 → Cu (красный налет) + Fe(NO3)2
2) Cu(NO3)2 + K2S → 2KNO3 + CuS
Переводим этот предварительный ответ в последовательность цифр, соответствующих нужным веществам.
Ошибка.
Попробуйте повторить позже
При добавлении к окрашенному раствору вещества Х серной кислоты наблюдали изменение цвета раствора. При добавлении к полученному раствору соляной кислоты наблюдали выделение газа и изменение окраски раствора, отличающегося от исходного, в связи с образованием соли Y. Определите вещества X и Y.
1) FeCl3
2) K4[Fe(СN)6]
3) K2MnO4
4) СrCl3
5) K2CrO4
Источники:
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором вещества X. В одну из них добавили раствор хлорида бария и наблюдали выпадение белого осадка, а в другую - раствор слабого электролита Y. При этом наблюдали выпадение бурого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфат железа (III)
2) сульфат магния
3) гидроксид меди(II)
4) аммиак (р-р)
5) Сульфат меди (II)
Источники:
Составим предварительную схему:
X (р-р) + BaCl2 (р-р) → белый осадок.
X (р-р) + Y (слаб. электролит, р-р) → бурый осадок.
Этой схеме соответствует:
а) 3BaCl2 + Fe2(SO4)3 → 3BaSO4 + 2FeCl3
б) Fe2(SO4)3 + 6NH3 + 6H2O → 2Fe(OH)3 + 3(NH4)2SO4
Следовательно, X - сульфат железа (III), Y - аммиак (р-р).
Но почему так? Давайте разберемся, почему X - сульфат железа (III).
Из всего списка с раствором хлорида бария не реагируют гидроксид меди (II) так как нерастворимое с солями просто так не реагирует. Также раствор аммиака не реагирует с хлоридом бария, ибо не образуется газ/ вода/ осадок (если предположить, что это реакция ионного обмена). Остальные реактивы - растворимые сульфаты, которые способны дать с хлоридом бария белый осадок. Чтобы понять лучше, нужно рассмотреть вторую реакцию.
Ищем раствор слабого электролита. Растворимые сульфаты - сильные электролиты, раствора гидроксида меди быть не может, так как он - нерастворим. Остается раствор аммиака. Он нам подходит и как реактив, и как Y.
После первой реакции мы выяснили что нам подходят на роль X сульфаты. Следовательно, между сульфатами и р-ром аммиака будет происходить реакция обмена. Условно представим (для простоты, так писать в реакциях не надо) раствор аммиака как NH4OH. Раз реакция ионного обмена, то у нас два варианта получения бурого осадка: либо при взаимодействии сульфат-аниона и катиона аммония, либо при взаимодействии катиона металла и гидроксид-аниона. Но сульфат аммония не бурый и растворим, следовательно, нам подходит второй вариант исхода.
Смотрим какой катион может дать с гидроксид-анионом бурый осадок. Катион магния даст белый осадок, катион меди даст синий осадок, а вот катион железа даст бурый осадок. Поэтому он и подходит, следовательно, он - Х.
Переводим этот предварительный ответ в последовательность цифр, соответствующих нужным веществам.
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором хлорида железа (II). В одну из них добавили раствор вещества X, в резултате образовалось нерастворимое основание. В другую пробирку добавили раствор вещества Y. В ней произошла реакция, которую описывает сокращённое ионное уравнение
Fe2+ + 2F- = FeF2
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) фтороводородная кислота
2) нитрат аммония
3) гидроксид лития
4) фторид калия
5) нитрат серебра
Составим предварительную схему:
FeCl2 + Х → нерастворимое основание
FeCl2 + Y (Fe2+ + 2F- = FeF2)
Этой схеме соответствует:
А) FeCl2 + 2LiOH → 2LiCl + Fe(OH)2
Б) FeCl2 + KF → KCl + FeF2
Следовательно, X - LiOH, Y - KF
Ошибка.
Попробуйте повторить позже
В раствор с веществом Х добавили раствор соли Y. В результате наблюдали выпадение осадка белого цвета, который со временем изменил окраску. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанную реакцию
1) нитрат железа (III)
2) гидроксид магния
3) сульфат железа (II)
4) гидроксид натрия
5) серная кислота
Источники:
Подходящая реакция - это окисление белого осадка Fe(OH)₂ кислородом воздуха до бурого Fe(OH)₃. Для этого нам нужен сульфат железа(II) (FeSO₄) и гидроксид натрия (NaOH).
2NaOH + FeSO4 → Fe(OH)2↓ + Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Ответ: 43
Ошибка.
Попробуйте повторить позже
В раствор с веществом Х добавили вещество Y. В результате наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанную реакцию
1) железо
2) магний
3) цинк
4) гидроксид натрия
5) кремниевая кислота
Источники:
Вещества, которые реагируют с выделением бесцветного газа, это металл и кислота или щелочь. Из списка нам подходит цинк (Zn) и гидроксид натрия (NaOH). Цинк - амфотерный металл, реагирует с щелочами в растворе.
Zn + 2NaOH + 2H₂O → Na₂[Zn(OH)₄] + H₂↑
Ответ: 43
Ошибка.
Попробуйте повторить позже
В раствор соли Х медленно по каплям добавили раствор вещества Y. В результате наблюдали выпадение белого объемного осадка, который растворяется при добавлении избытка вещества Y. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанную реакцию
1) HBr
2) Mg(OH)2
3) FeSO4
4) Na2[Zn(OH)4]
5) Ba(NO3)2
Источники:
Na₂[Zn(OH)₄] + 2HBr → Zn(OH)₂↓ + 2NaBr + 2H₂O
Zn(OH)₂ - белый осадок, выпадающий при реакции.
Zn(OH)₂ + 2HBr → ZnBr₂ + 2H₂O
Осадок Zn(OH)₂ растворяется в избытке HBr.
Ответ: 41
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором вещества Х. В одну из них добавили раствор аммиака, при этом наблюдали образование бурого осадка, а в другую - раствор соли Y. При этом наблюдали как образование осадка, так и выделение газа.
Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции
1) CaCO3
2) AlCl3
3) FeCl3
4) FeCl2
5) Na2CO3
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором бромида меди(II). В первую пробирку добавили металл Х, в результате наблюдали образование красноватого налёта на его поверхности. Во вторую пробирку добавили раствор вещества Y. В этой пробирке произошла реакция, которую описывает сокращённое ионное уравнение:
Cu2+ + S2- = CuS
Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) сульфид натрия
2) серебро
3) железо
4) сероводород
5) гидросульфид калия
Источники:
Составим предварительную схему:
1) CuBr2 (р-р) + X (металл) → красный налет (осадок)
2) CuBr2 (р-р) + Y (раствор), реакцию описывает ионное уравнение: Cu2+ + S2- = CuS
На роль X подходят металлы, а на роль Y - жидкие/ растворимые вещества (так как вещество Y - раствор, раствор представляет собой смесь растворителя (воды) и растворенных в нем веществ). Металлы из списка: серебро, железо. Растворимые вещества: сульфид натрия, сероводород, гидросульфид калия.
Этой схеме соответствуют следующие реакции:
1) CuBr2 + Fe → FeBr2 + Cu (красноватый налет)
При реакции с железом происходит реакция замещения: железо как более активный металл, чем медь, вытесняет ее из соли, соль не является сильным окислителем, поэтому железо поднимает свою степень окисления до +2, а не до +3. Серебро менее активный металл, чем медь, поэтому серебро не сможет вытеснить медь из соли, реакции не будет. Следовательно, вещество X - железо.
2) Na2S + CuBr2 → CuS + 2NaBr
Из ионного уравнения следует, что в ходе реакции должен получиться сульфид меди (II), а также что вещество Y способно диссоциировать на ионы и несет в себе сульфид-анион (сульфид-анион этого вещества, соединяясь с катионом меди, образует сульфид меди). Нам подходит именно сульфид натрия, так как это растворимая соль, способная диссоциировать на ионы и несущая в себе сульфид-анион. Сероводород не распадается на ионы, в воде будет образовывать слабую сероводородную кислоту, а слабые кислоты не распадаются на ионы. С гидросульфидом калия реакции до сульфида меди не будет, к тому же он будет распадаться в воде на гидросульфид-анион и катион калия, что также не соответствует условию. Следовательно, вещество Y - сульфид натрия.
Переводим этот предварительный ответ в последовательность цифр, соответствующих нужным веществам.
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором хлорида железа(II). В одну из них добавили раствор вещества X, а в другую – раствор вещества Y. В результате в пробирке с веществом Х образовалось нерастворимое основание. А в пробирке с веществом Y произошла реакция, которую описывает сокращённое ионное уравнение
Fe2+ + 2F- = FeF2
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) фтороводородная кислота
2) нитрат серебра
3) нитрат аммония
4) гидроксид лития
5) фторид калия
Источники:
Ошибка.
Попробуйте повторить позже
В одну пробирку с раствором хлорида меди(II) добавили вещество X, и в результате реакции наблюдали образование осадка красного цвета. В другую пробирку с раствором хлорида меди(II) добавили раствор вещества Y. В результате реакции образовалась нерастворимая соль. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) оксид цинка
2) серебро
3) фторид серебра
4) цинк
5) бромид калия
Источники:
В одну пробирку с раствором хлорида меди(II) добавили вещество X, и в результате реакции наблюдали образование осадка красного цвета.
Отсюда понимаем, что добавили какой-то активный металл, в результате чего выделилась медь. Под условие подходит цинк (4).
В другую пробирку с раствором хлорида меди(II) добавили раствор вещества Y. В результате реакции образовалась нерастворимая соль.
Нерастворимой солью является AgCl. Так как больше никаких нерастворимых солей по условию быть не может. Само серебро не будет реагировать с CuCl2, так как оно менее активнее меди. Под условие подходит фторид серебра (3).
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором хлорида железа (II). В одну из них добавили раствор вещества X, в результате образовалось нерастворимое основание. В другую пробирку добавили раствор вещества Y. В ней произошла реакция, которую описывает сокращенное ионное уравнение
Fe2+ + 2F− = FeF2
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) фтороводородная кислота
2) нитрат аммония
3) гидроксид лития
4) фторид калия
5) нитрат серебра
Источники:
Вещество X (образование нерастворимого основания):
При добавлении гидроксида лития (LiOH) к FeCl₂ происходит реакция:
FeCl2+2LiOH→Fe(OH)2↓+2LiCl
Гидроксид железа(II) (Fe(OH)2) — нерастворимое основание.
Вещество Y (реакция с Fe2+):
Фторид калия (KF) диссоциирует на ионы K+и F-. Ионы F- связываются с Fe2+, образуя FeF2:
FeCl2+2KF→FeF2↓+2KCl
Сокращённое ионное уравнение:
Fe2++2F−→FeF2↓
Правильный ответ: 34
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором сульфата железа(II). В первую пробирку добавили раствор сильного электролита Х, а во вторую — раствор слабого электролита Y. В результате в каждой пробирке наблюдали образование осадка. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) хлорид серебра
2) карбонат натрия
3) гидроксид меди(I)
4) аммиак
5) оксид азота(IV)
Источники:
Вещество Х (сильный электролит):
2) карбонат натрия
FeSO4+Na2CO3→FeCO3 ↓+Na2SO4
Образуется осадок карбоната железа(II). Карбонат натрия - сильный электролит (полностью диссоциирует на ионы).
Вещество Y (слабый электролит):
4) аммиак (NH3).
FeSO4+2NH3+2H2O→Fe(OH)2 ↓+(NH4)2SO4
Образуется осадок гидроксида железа(II) (Fe(OH)2). Аммиак - слабый электролит (частично диссоциирует в воде).
Правильный ответ: 24
Ошибка.
Попробуйте повторить позже
Даны две пробирки с раствором нитрата железа(II). В одну из них добавили раствор вещества X, в результате образовалось нерастворимое основание. В другую пробирку добавили раствор вещества У. В ней произошла реакция, которую описывает сокращённое ионное уравнение
Fe2+ + 2F- = FeF2
Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) фтороводородная кислота
2) хлорид аммония
3) гидроксид кальция
4) фторид кальция
5) фторид серебра
Источники:
Реакция с веществом X
При добавлении вещества X к раствору Fe(NO3)2 образуется нерастворимое основание. Раствор Fe(NO3)2 содержит ионы Fe²⁺. Нерастворимым основанием, которое может образоваться, является гидроксид железа(II) , так как он выпадает в осадок.
Чтобы осадить Fe(OH)2, необходимо добавление основания, которое предоставляет ионы OH-.
Из предложенного перечня веществ:
Гидроксид кальция - растворимое основание, при диссоциации дает ионы OH-. При добавлении к Fe(NO3)2 происходит реакция:
Fe(NO3)2 +Ca(OH)2→Fe(OH)2 ↓+ Ca(NO3)2
Образуется нерастворимое основание Fe(OH)2
Реакция с веществом Y
При добавлении вещества Y к раствору Fe(NO3)2 происходит реакция, описываемая сокращенным ионным уравнением:
Fe2++2 F−→ FeF2
Это означает, что образуется фторид железа(II) (FeF2), который является нерастворимым соединением (выпадает в осадок). Вещество Y должно быть источником ионов F-.
Из предложенного перечня веществ:
AgF - растворяется в воде, диссоциирует с образованием ионов F-. При добавлении к Fe(NO3)2 происходит реакция:
Fe(NO3)2+2AgF→FeF2 ↓ + 2AgNO3
Правильный ответ: 35



