Первое начало термодинамики (страница 2)
Готовиться с нами - ЛЕГКО!

Внутренняя энергия газа в процессе эксперимента увеличилась на 33 кДж, при этом внешние силы совершили работу на газом, равную 51 кДж. Какое количество теплоты газ отдал окружающей среде? Ответ выразить в кДж.
По первому закону термодинамики: \[Q=\Delta U + A,\] где \(Q\) — количество теплоты, \(\Delta U\) — изменение внутренней энергии газа, а \(A\) — работа, совершенная газом. \[A=-A_{\text{вн}},\] где \(A_{\text{вн}}\) — работа внешних сил над газом.
Отсюда: \[Q=\Delta U-A_{\text{вн}}=33\text{ кДж}-51\text{ кДж}=-18\text{ кДж }\] Значит, газ отдал окружающей среде количество теплоты, равное 18 кДж.
Некоторое количество идеального одноатомного газа нагреваются в плотно закрытом сосуде. Зная, что масса газа \(m = 200\) г и газ получил количество теплоты \(Q = 900\) Дж. Определите, на сколько повысилась температура азота, если молярная масса газа равна \(M=0,028 \) кг/моль. Ответ округлить до целых.
По первому закону термодинамики: \[Q=\Delta U + A,\] где \(Q\) — количество теплоты, полученное газом, \(\Delta U=\dfrac{3}{2}\dfrac{m}{M} R\Delta T\) — изменение внутренней энергии газа, а \(A\) — работа, совершенная газом.
\(A=0\), т.к. по условию \(V=const\) (сосуд плотно закрыт).
Отсюда: \[Q=\Delta U=\dfrac{3}{2}\dfrac{m}{M} R\Delta T\] Осталось выразить \(\Delta T\): \[\Delta T=\dfrac{2QM}{3m R}=\dfrac{2\cdot900\text{ Дж}\cdot0,028\text{ кг/моль}}{3\cdot 0,2\text{ кг}\cdot 8,31\text{ Дж/(моль $\cdot$ К)}}\approx 10~K\]
В процессе адиабатного сжатия над 2 молями идеального одноатомного газа совершают работу 980,5 Дж. Определите модуль изменения температуры данной порции газа в результате этого процесса. Ответ округлить до целых.
По первому закону термодинамики: \[Q=\Delta U + A\] В адиабатном процессе газ не получает теплоты от внешней среды: \[0=\Delta U + A \Rightarrow U=-A\] \[\Delta U=\dfrac{3}{2}\nu R\Delta T\] Отсюда: \[-A=\dfrac{3}{2}\nu R\Delta T\] \[|\Delta T|=\dfrac{2A}{3\nu R}=\dfrac{2\cdot 980,5\text{ Дж}}{3\cdot 2\text{ моль}\cdot 8,31\text{ Дж/(моль$\cdot$ К)}}\approx 39 \text{ К }\]
В некотором процессе газ отдал окружающей среде количество теплоты, равное 10 кДж. При этом внутренняя энергия газа увеличилась на 30 кДж. Определите работу, которую совершили внешние силы, сжав газ. Ответ дайте в кДж.
“Демоверсия 2017”
По первому закону Термодинамики: \[Q=\Delta U - A \Rightarrow A=\Delta U - Q= 30\text{ кДж}-(-10\text{ кДж})=40\text{ кДж}\] где \(Q\) – переданное количество теплоты, \(\Delta U\) – изменение внутренней энергии, \(A\) – работа над газом.
На ТV – диаграмме показан процесс изменения состояния идеального одноатомного газа. Газ получил количество теплоты, равное 50 кДж. Какую работу совершил газ в этом процессе, если его масса не меняется? Ответ дайте в кДж.
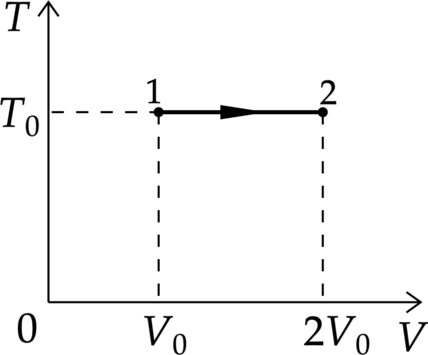 ’
’
“Демоверсия 2018”
Из первого начала термодинамики для изотермического процесса(изменение внутренней энергии равно 0) \[Q=A\]
На рисунке показан циклический процесс изменения состояния постоянной массы одноатомного идеального газа. На каком участке работа внешних сил над газом положительна и равна отданному газом количеству теплоты
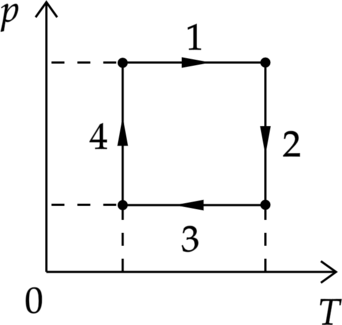
“Демоверсия 2019”
Так как работа внешних сил над газом положительна и равна отданному газом количеству теплоты, то процесс изотермический, значит это либо 2, либо 4. Работа внешних сил положительна, следовательно, объем уменьшается. Это соответствует участку 4.


