Молекулярно-кинетическая теория. Газовые законы
Готовиться с нами - ЛЕГКО!
Теоретическая справка
#966
Основные положения молекулярно-кинетической теории
1) Любое вещество состоит из мельчайших частиц — молекул и атомов. Они расположены в пространстве дискретно, то есть на некоторых расстояниях друг от друга.
2) Атомы или молекулы вещества находятся в состоянии беспорядочного движения, которое никогда не прекращается.
3) Атомы или молекулы вещества взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами.
Идеальный газ
Идеальный газ — это газ, частицы которого являются не взаимодействующими на расстоянии материальными точками и испытывают абсолютно упругие соударения друг с другом и со стенками сосуда.
Основное уравнение МКТ
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Из-за соударений молекулы оказывают давление на стенки.
Основное уравнение МКТ идеального газа:
где — давление,
— масса одной молекулы,
— концентрация,
— средняя квадратичная
скорость.
Единицы измерения:
Па — паскаль.
Средняя квадратичная скорость:
Концентрация:
где N — число молекул в объеме V.
Вывод основного уравнения МКТ
В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы
со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция
скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция
скорости,
параллельная стенке, остается неизменной (см. рисунок).
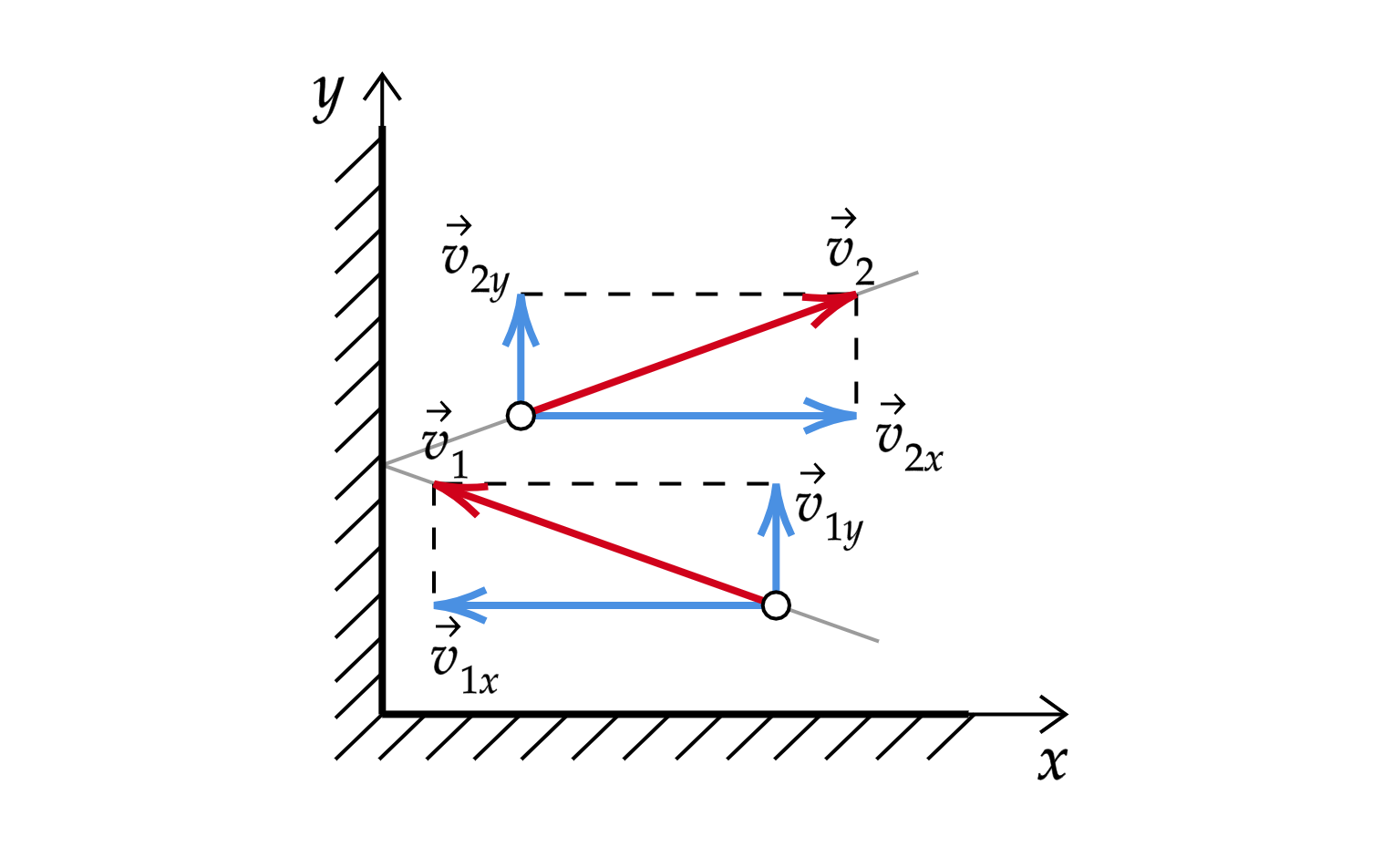
Поэтому изменение импульса молекулы будет равно , где
— масса молекулы.
Выделим на стенке некоторую площадку (см. рисунок). За время
с этой площадкой столкнутся все
молекулы, имеющие проекцию скорости
, направленную в сторону стенки, и находящиеся в цилиндре с основанием
площади
и высотой
.
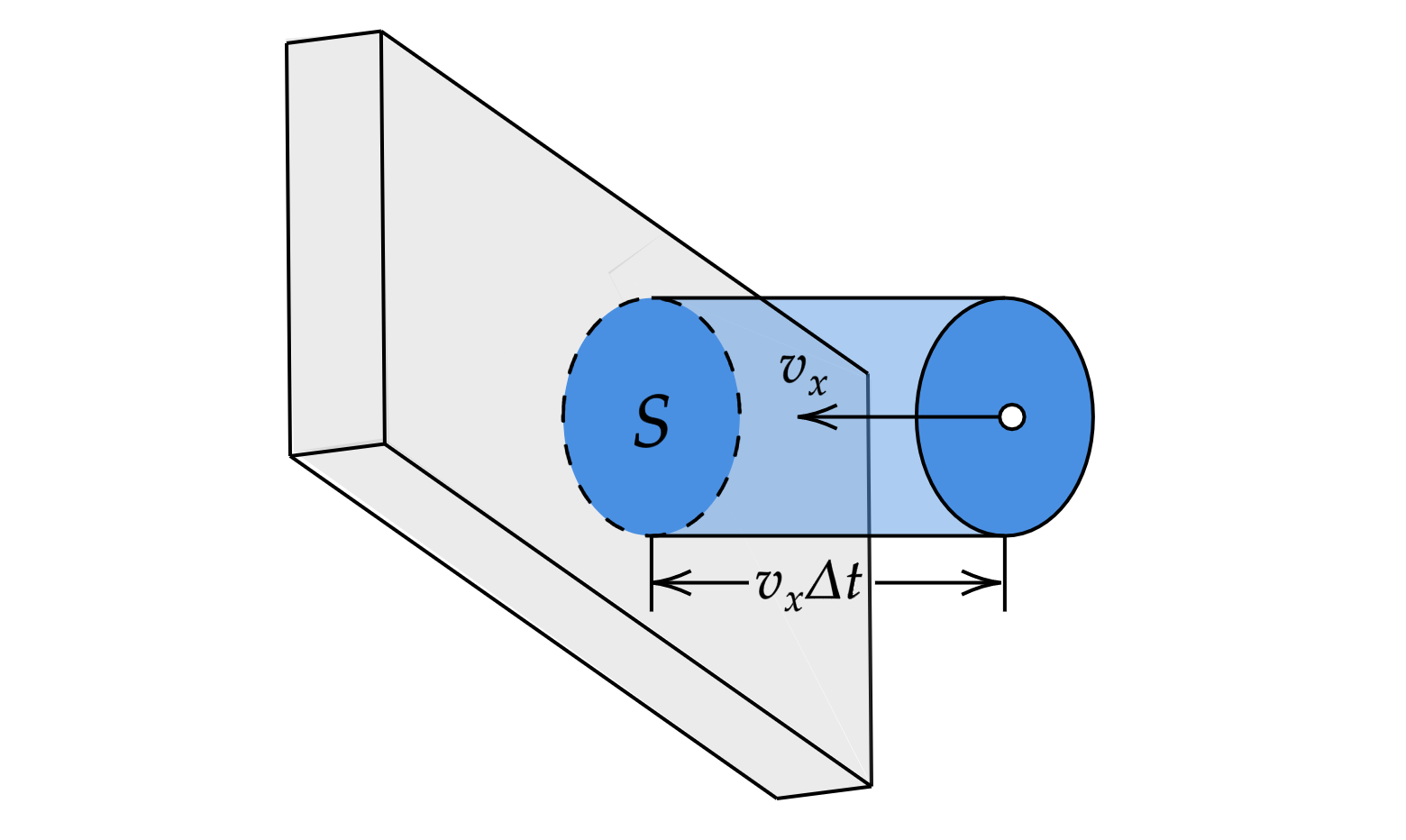
Пусть в единице объема сосуда содержатся молекул; тогда число молекул в объеме цилиндра равно
. Но
из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном
направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку
за время
равно
.
Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное
изменение импульса всех молекул, столкнувшихся за время
с площадкой
, равно
.
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием
импульса силы , где
— некоторая средняя сила, действующая на молекулы со стороны стенки на площадке
. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку
. Поэтому
можно записать:
Разделив обе части на , получим:
где — давление газа на стенку сосуда.
При выводе этого соотношения предполагалось, что все молекул, содержащихся в единице объема газа, имеют
одинаковые проекции скоростей на ось X. На самом деле это не так.
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными, а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям.
Теперь формулу для давления газа можно записать в виде
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
Последнее равенство вытекает из формулы:
Формула для среднего давления газа на стенку сосуда запишется в виде
где — средняя кинетическая энергия молекул — среднее арифметическое их кинетических энергий.
Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Кинетическая энергия
МКТ рассматривает тепловое движение — движение, при котором молекулы хаотично двигаются. Молекулы при хаотичном движении имеют некоторую скорость и обладают кинетической энергией. Кинетическая энергия теплового (хаотического) движения характеризует температуру тела. Температура тела показывает, насколько быстро двигаются молекулы.
Кинетическая энергия поступательного движения одной молекулы:
где — постоянная Больцмана,
— абсолютная температура.
Данная формула показывает, что температура тела является характеристикой кинетической энергии поступательного движения каждой молекулы в отдельности.
Средняя квадратичная скорость
Кинетическая энергия движения одной молекулы по определению:
Приравняем данное выражение к предыдущему:
Средняя квадратичная скорость движения одной молекулы:
Варианты основного уравнения МКТ
1. Выведенное ранее основное уравнение МКТ имеет вид:
2. Домножим и поделим уравнение под номером 1 на 2:
3. Подставим в уравнение под номером 2 выражение для кинетической энергии:
Температурная шкала Кельвина
В МКТ для температур принято использовать абсолютную шкалу Кельвина.
Единицы измерения:
К — кельвин.
Перевод из шкалы Цельсия в шкалу Кельвина:
где — температура в градусах Цельсия.
У шкалы Кельвина существует абсолютный ноль, ниже которого ничего нет:
В классической физике принято считать, что при температуре 0 кельвинов молекулы перестают двигаться и тепловое движение прекращается.
Количество вещества
Работать с массами молекул зачастую неудобно. В связи с этим вводится понятие количества вещества
.
Единицы измерения:
— моль.
1 моль — это молекулярная «упаковка», содержащая определенное количество молекул. Моль любого вещества содержит одно и то же число молекул — число Авогадро.
Количество вещества можно найти по формулам:
где — количество молекул (в штуках),
— масса вещества,
— молярная масса вещества.
Молярная масса
Молярная масса — масса одного моля вещества, или масса одной «упаковки» молекул.
Единицы измерения:
кг/моль.
Молярную массу можно найти, используя таблицу Менделеева.
Например, молекула воды содержит два атома водорода и один атом кислорода и имеет химическую
формулу . Атомная масса водорода из таблицы Менделеева 1, атомная масса кислорода 16, причем
атом водорода «повторяется» в молекуле 2 раза, а атом кислорода — один раз. Исходя из этого, найдем
молярную массу молекулы воды:
18 г/моль. В системе СИ:
кг/моль.
Уравнение состояния идеального газа
Уравнение Клапейрона-Менделеева, или уравнение состояния идеального газа, связывает три макроскопических параметра газа.
где — давление газа,
— его объем,
— количество вещества (
— масса газа,
— его
молярная масса),
— абсолютная температура газа,
— универсальная газовая
постоянная.
Уравнение Клапейрона-Менделеева также можно записать в виде
Изопроцессы
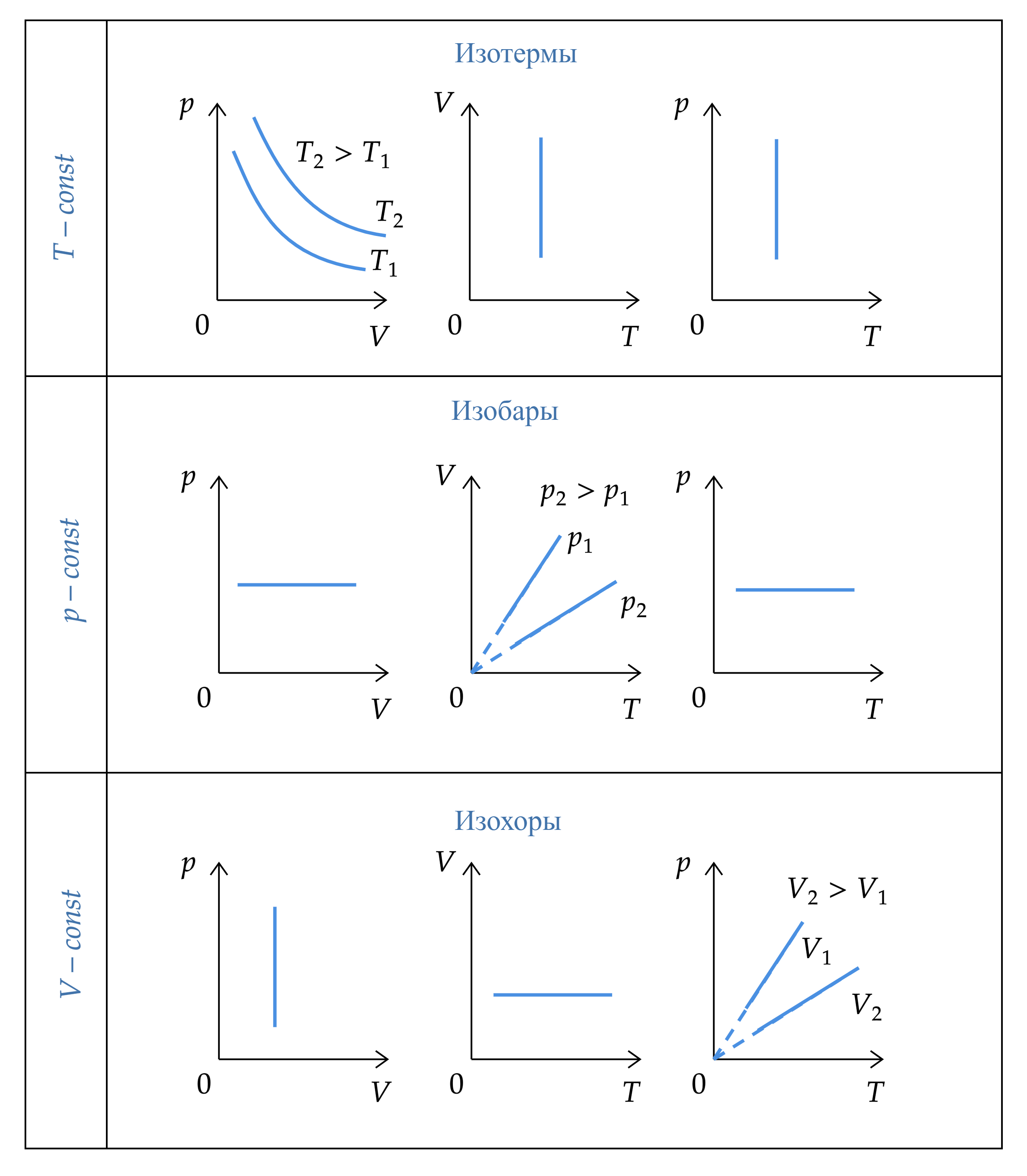
Изопроцессы — термодинамические процессы, во время которых количество вещества газа и один из параметров состояния: давление, объём или температура — остаётся неизменным.
-
Изотермический процесс
— по закону Бойля-Мариотта
-
Изохорный процесс
— по закону Шарля
-
Изобарный процесс
— по закону Гей-Люссака
Графики изопроцессов