22. Химическое равновесие
Готовиться с нами - ЛЕГКО!
Ошибка.
Попробуйте повторить позже
Установите соответствие между уравнением химической реакции и изменением условий её проведения, которые одновременно приводят к смещению химического равновесия в сторону прямой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ УСЛОВИЙ |
| А) N2(г) + 3H2(г) ⇆ 2NH3(г) + Q | 1) увеличение температуры и давления |
| Б) N2O4(ж) ⇆ 2NO2(г) - Q | 2) уменьшение температуры и давления |
| В) CO2(г) + C(тв) ⇆ 2CO(г) - Q | 3) увеличение температуры и уменьшение давления |
| Г) 2HCl(г) + O2 ⇆ 2H2O(г) + 2Cl2(г) + Q | 4) уменьшение температуры и увеличение давления |
Источники:
А) N2(г) + 3H2(г) ⇆ 2NH3(г) + Q
Тепловой эффект: +Q (экзотермическая) → смещение вправо при уменьшении температуры.
Число молей газов: слева 4 моля , справа 2 моля → смещение вправо при увеличении давления
Итог: уменьшение T и увеличение P → ответ 4
Б) N2O4(ж) ⇆ 2NO2(г) - Q
Тепловой эффект: -Q (эндотермическая) → смещение вправо при увеличении температуры
Число молей газов: слева жидкость , справа 2 моля газа → смещение вправо при уменьшении давления
Итог: увеличение T и уменьшение P → ответ 3
В) CO2(г) + C(тв) ⇆ 2CO(г) - Q
Тепловой эффект: -Q (эндотермическая) → смещение вправо при увеличении температуры
Число молей газов: слева 1 моль газа , справа 2 моля газа , твердый углерод не учитывается → смещение вправо при уменьшении давления
Итог: увеличение T и уменьшение P → ответ 3
Г) 2HCl(г) + O2(г) ⇆ 2H2O(г) + 2Cl2(г) + Q
Тепловой эффект: +Q (экзотермическая) → смещение вправо при уменьшении температуры
Число молей газов: слева 3 моля , справа 4 моля → смещение вправо при уменьшении давления
Итог: уменьшение T и уменьшение P → ответ 2
Правильный ответ: 4332
Ошибка.
Попробуйте повторить позже
Установите соответствие между уравнением химической реакции и смещением химического равновесия при увеличении давления в системе; к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
| А) N2(г) + O2(г) ⇆ 2NO(г) - Q | 1) смещается в сторону прямой реакции |
| Б) 3O2(г) ⇆ 2O3(г) - Q | 2) смещается в сторону обратной реакции |
| В) H2CO3(р-р) ⇆ CO2(г) + H2O(ж) - Q | 3) практически не смещается |
| Г) 4HCl(г) + O2(г) ⇆ 2H2O(г) + 2Cl2(г) + Q |
Источники:
Вспомним, что при увеличении давления равновесие смещается в сторону уменьшения количества газообразных веществ (меньшего числа моль газов).
А) N2(г) + O2(г) ⇆ 2NO(г) - Q
Изменение давления не влияет на равновесие (количество газов одинаково).
Ответ: 3 (практически не смещается).
Б) 3O2(г) ⇆ 2O3(г) - Q
При увеличении давления равновесие смещается в сторону меньшего числа моль газов (к продуктам).
Ответ: 1 (в сторону прямой реакции).
В) H2CO3 (р-р) ⇆ CO2(г) + H2O(ж) - Q
При увеличении давления равновесие смещается в сторону меньшего числа моль газов (к реагентам).
Ответ: 2 (в сторону обратной реакции).
Г) 4HCl(г) + O2(г) ⇆ 2H2O(г) + 2Cl2(г) + Q
При увеличении давления равновесие смещается в сторону меньшего числа моль газов (к продуктам).
Ответ: 1 (в сторону прямой реакции).
Правильный ответ: 3121
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
H+(р−р)+ClO−(р−р)⇌HClO(р−р)+Q
и смещением химического равновесия в результате этого воздействия:
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
|---|---|
| А) добавление HNO3 | 1) смещается в сторону прямой реакции |
| Б) добавление твёрдого NaClO | 2) смещается в сторону обратной реакции |
| В) понижение давления | 3) практически не смещается |
| Г) понижение температуры |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
NH4+(р-р) + OH–(р-р) ↔ NH3(р-р) + H2O(ж) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
| А) добавление раствора NaOH Б) добавление твёрдого NН4Cl В) понижение давления Г) повышение температуры |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между фактором, действующим на равновесную систему
CH3COOH(ж) + CH3OH(ж) ⇆ CH3COOCH3(ж) + H2O(ж),
и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФАКТОР | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление метанола | 1) смещается в сторону прямой реакции |
| Б) повышение давления | 2) смещается в сторону обратной реакции |
| В) повышение концентрации эфира | 3) равновесие практически не смещается |
| Г) добавление гидроксида натрия |
Источники:
А) Добавление метанола (CH3OH) : по принципу Ле Шателье: увеличение концентрации реагента смещает равновесие вправо (для уменьшения его количества). Направление: 1 (прямая реакция).
Б) Повышение давления : все вещества в системе - жидкости, их объём практически не зависит от давления. Направление: 3 (равновесие не смещается).
В) Повышение концентрации эфира (CH3COOCH3) : увеличение концентрации продукта смещает равновесие влево (для его расходования). Направление: 2 (обратная реакция).
Г) Добавление гидроксида натрия (NaOH) : NaOH нейтрализует уксусную кислоту:
CH3COOH + NaOH → CH3COONa + H2O
Уменьшение концентрации CH3COOH смещает равновесие влево (для её восполнения). Направление: 2 (обратная реакция).
Правильный ответ: 1322
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
PBr3 (г) + Br2 (г) ⇆ PBr5 (г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) уменьшение концентрации паров брома | 1) в сторону продуктов реакции |
| Б) увеличение концентрации трибромида фосфора | 2) в сторону исходных веществ |
| В) увеличение давления | 3) практически не смещается |
| Г) увелиение температуры |
Источники:
А) Уменьшение концентрации паров брома смещает равновесие в сторону восполнения убыли Br2, т.е. в сторону разложения PBr5 ,в сторону исходных веществ.
Б) Увеличение концентрации трибромида фосфора смещает равновесие в сторону расхода избытка PBr3, т.е. в сторону образования PBr5,в сторону продуктов реакции.
В) Увеличение давления смещает равновесие в сторону меньшего числа молей газов (т.е. вправо), 1) в сторону продуктов реакции.
Г) Увеличение температуры смещает равновесие в сторону поглощения тепла (эндотермическая реакция), т.е. влево, в сторону исходных веществ.
Правильный ответ: 2112
Ошибка.
Попробуйте повторить позже
Установите соответствие между уравнением обратимой химической реакции и одновременным изменением внешних условий, приводящих к смещению химического равновесия в сторону продуктов реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ УСЛОВИЙ |
| А) N2(г) + 3H2(г) ⇆ 2NH3(г) + Q | 1) увеличение температуры и увеличение давления |
| Б) N2O4(ж) ⇆ 2NO2(г) - Q | 2) уменьшение температуры и уменьшение давления |
| В) CO2(г) + C(тв) ⇆ 2CO(г) - Q | 3) увеличение температуры и уменьшение давления |
| Г) 4HCl(г) + O2(г) ⇆ 2H2O(г) + Cl2(г) + Q | 4) уменьшение температуры и увеличение давления |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между фактором, действующим на равновесную систему
HCOOH(ж) + C2H5OH(ж) ⇆ HCOOC2H5 (ж) + H2O(ж),
и направлением смещения химического равновесия в этой системе: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
| ФАКТОР | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление этанола | 1) смещается в сторону прямой реакции |
| Б) повышение давления | 2) смещается в сторону обратной реакции |
| В) повышение концентрации эфира | 3) практически не смещается |
| Г) добавление гидроксида натрия |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между фактором, действующим на равновесную систему
CH4(г) + O2(г) ⇆ HCHO(г) + H2O(г) + Q,
и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФАКТОР | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление метаналя | 1) смещается в сторону прямой реакции |
| Б) повышение давления | 2) смещается в сторону обратной реакции |
| В) повышение концентрации кислорода | 3) практически не смещается |
| Г) увеличение температуры |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) N2(г) + 3H2(г) ⇆ 2NH3(г) | 1) смещается в сторону прямой реакции |
| Б) 2H2O(г) ⇆ 2H2(г) + O2(г) | 2) смещается в сторону обратной реакции |
| В) 2HCl(г) ⇆ H2(г) + Cl2(г) | 3) равновесие практически не смещается |
| Г) SO2Cl2(г) ⇆ SO2(г) + Cl2(г) |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
2NH3(г) ⇆ N2(г) + 3H2(г) - Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ |
| А) увеличение концентрации азота | 1) смещается в сторону прямой реакции |
| Б) добавление катализатора | 2) смещается в сторону обратной реакции |
| В) повышение температуры | 3) практически не смещается |
| Г) понижение давления |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
FeS(тв) + 2H+(р-р) ⇆ Fe2+(р-р) + H2S(г) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры | 1) смещается в сторону прямой реакции |
| Б) добавление хлорной кислоты | 2) смещается в сторону обратной реакции |
| В) добавление твёрдого хлорида железа(II) | 3) практически не смещается |
| Г) повышение давления |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
SO2(г) + H2O(ж) ⇆ H+(р-р) + HSO3-(р-р) - Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение давления | 1) смещается в сторону прямой реакции |
| Б) понижение температуры | 2) смещается в сторону обратной реакции |
| В) добавление твёрдого гидросульфита калия | 3) практически не смещается |
| Г) добавление HCl |
Источники:
А) при повышении давления по принципу Ле-Шателье химическое равновесие смещается в сторону той части реакции, где газов меньше. Для оценки количества газов пользуется коэффициентами перед ним. Слева 1 моль газов (сернистый газ), справа газов нет. Таким образом, при повышении давления химическое равновесие сместится в сторону прямой реакции, ответ 1;
Б) при понижении температуры по приниципу Ле-Шателье химическое равновесие смещается в сторону той части реакции, где происходит выделение тепла (экзотермическая реакция), которая обозначается "+ Q". Так как справа мы видим "- Q", то экзотермической является обратная реакция. Таким образом, при понижении температуры равновесие сместится в сторону обратной реакции, ответ 2;
В) реакция протекает в водном растворе, поэтому при добавлении твердого гидросульфита калия происходит реакция электролитической диссоциации:
KHSO3 = K+ + HSO3-
При этом повышается концентрация гидросульфит-аниона в правой части уравнения. По принципу Ле-Шателье при повышении концентрации вещества химическое равновесие смещается в сторону той части реакции, где оно расходуется. Таким образом, при добавлении твердого гидросульфита калия химическое равновесие смещается в сторону обратной реакции, ответ 2;
Г) реакция протекает в водном растворе, поэтому при добавлении хлороводорода происходит реакция электролитической диссоциации:
HCl = H+ + Cl-
При этом повышается концентрация катионов водорода в правой части уравнения. По принципу Ле-Шателье при повышении концентрации вещества химическое равновесие смещается в сторону той части реакции, где оно расходуется. Таким образом, при добавлении хлороводорода химическое равновесие смещается в сторону обратной реакции, ответ 2;
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
CH4(г) + H2O(г) ⇆ CO(г) + 3H2(г) - Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
| А) повышение давления | 1) смещается в сторону прямой реакции |
| Б) повышение температуры | 2) смещается в сторону обратной реакции |
| В) увеличение концентрации метана | 3) практически не смещается |
| Г) увеличение концентрации оксида углерода(II) |
Источники:
Ошибка.
Попробуйте повторить позже
Установите соответствие между способом воздействия на равновесную систему
Fe3+(р-р) + 3F–(р-р) ⇋ FeF3(р-р) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
| А) добавление твердого хлорида железа(III) | 1) смещается в сторону прямой реакции |
| Б) добавление твердого KF | 2) смещается в сторону обратной реакции |
| В) повышение температуры | 3) практически не смещается |
| Г) повышение давления |
Источники:
- Вспомним, какие факторы могут смещать равновесие химической реакции:
*Равновесие реакции смещается в соответствии с принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это воздействие (например, если нагреть систему, находящуюся в состоянии равновесия, она попытается вернуться в исходное состояние, снизив температуру).
| Факторы, смещающие химическое равновесие | ||
| Температура (Т) | Давление (р) | Концентрация (С) |
|
При повышении Т система находится в состоянии химического равновесия, стремится к её снижению, смещая равновесие в сторону эндотермической реакции (и наоборот):
|
Практически не смещает равновесие, если: 1) Ни в прямой, ни в обратной реакциях нет газообразных компонентов 2) Количество молекул газов в прямой и обратной реакциях одинаково |
При повышении С участников реакции, система, находящаяся в состоянии химического равновесия, стремится к снижению их концентрации (и наоборот):
|
|
При повышении р система, находящаяся в состоянии химического равновесия, стремится к его снижению, смещая равновесие в сторону реакции, в которой образуется меньше молекул газов (и наоборот):
|
||
*Введение в равновесную систему катализатора не смещает равновесие реакции, так как катализатор ускоряет прямую и обратную реакции в равной степени, что приводит к более быстрому достижению существующего равновесного состояния!
* Введение в равновесную систему щёлочи в присутствия в реагентах кислоты (например, в реакциях этерификации) приводит к уменьшению концентрации кислоты → равновесие в данном случае будет смещаться в сторону реакции, где кислота образуется.
- Разберём каждый пункт задания:
А) Добавление твёрдого хлорида железа (III):
– сильный электролит (так как является растворимой солью), в воде диссоциирует на Fe 3+ и Cl -, что приводит к увеличению концентрации катионов железа, следовательно равновесие смещается в сторону реакции, где катионы железа (Fe 3+) расходуются, то есть, в данном случае, в сторону прямой реакции (1).
Б) Добавление твёрдого KF:
– сильный электролит (так как является растворимой солью), в воде диссоциирует на K + и F -, что приводит к увеличению концентрации анионов фтора, следовательно равновесие смещается в сторону реакции, где анионы фтора (F -) расходуются, то есть, в данном случае, в сторону прямой реакции (1).
В) Повышение температуры
– при повышении температуры химическое равновесие смещается в сторону эндотермической реакции, то есть, в данном случае, в сторону обратной реакции (2).
Г) Повышение давления
– мы видим, что ни в прямой, ни в обратной реакциях нет газообразных компонентов. Это означает, что в данном случае равновесие практически не смещается (3).
- Запишем ответ. .
Ошибка.
Попробуйте повторить позже
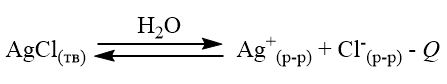
и направлением смещения равновесия при этом воздействии. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
| А) нагревание | 1) смещается в направлении прямой реакции |
| Б) увеличение давления | 2) смещается в направлении обратной реакции |
| В) добавление твёрдого AgCl | 3) практически не смещается |
| Г) добавление твёрдого AgNO3 |
Источники:






