Постулаты бора. Спектры излучения и поглощения
Готовиться с нами - ЛЕГКО!
Теоретическая справка
#595
Предыстория: модель атома Томсона
Первую модель атома предложил Джозеф Джон Томсон в 1904 году.
Модель «пудинга»/«булочки с изюмом»/«кекса»: сфера, равномерно заполненная положительным электричеством, внутри которой находятся электроны. Суммарный заряд этой сферы равен заряду электронов, атом в целом нейтрален.
Идея: существуют твердые тела, следовательно, атом должен быть чем-то заполнен. Данная идея выглядела правдоподобно.
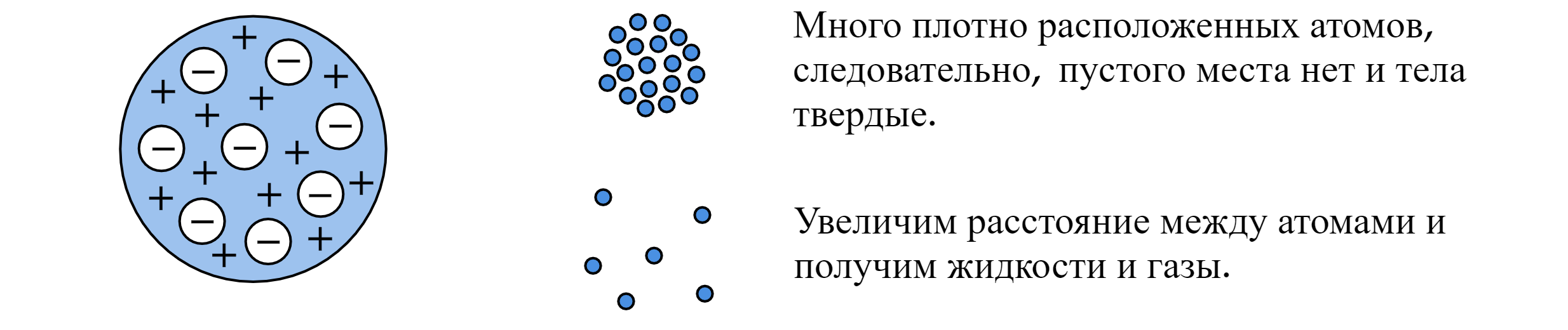
Противоречие: согласно модели Томсона спектр атома должен быть сложным, но никак не линейчатым. Это противоречило экспериментам. Теория строения атома по Томсону была опровергнута экспериментами, проведенными Эрнестом Резерфордом в 1911 году.
Модель атома Резерфорда
На момент экспериментов Резерфорда ученым уже было известно о существовании радиоактивных элементов, законах радиоактивного распада и о трех основных типах распада (альфа-, бета- и гамма-распады), при этом было также известно, что альфа-распад имеет самые тяжелые частицы — ядра гелия.
Резерфорд предположил, что, если направить поток альфа-частиц на тонкую золотую фольгу, состоящую согласно модели атома Томсона из плотно расположенных атомов, то альфа-частицы в теории не должны пройти сквозь нее.

Проведя эксперимент, Резерфорд получил, что рассеянные альфа-частицы ударялись об экран, покрытый сернистым цинком, и вызывали вспышки света.
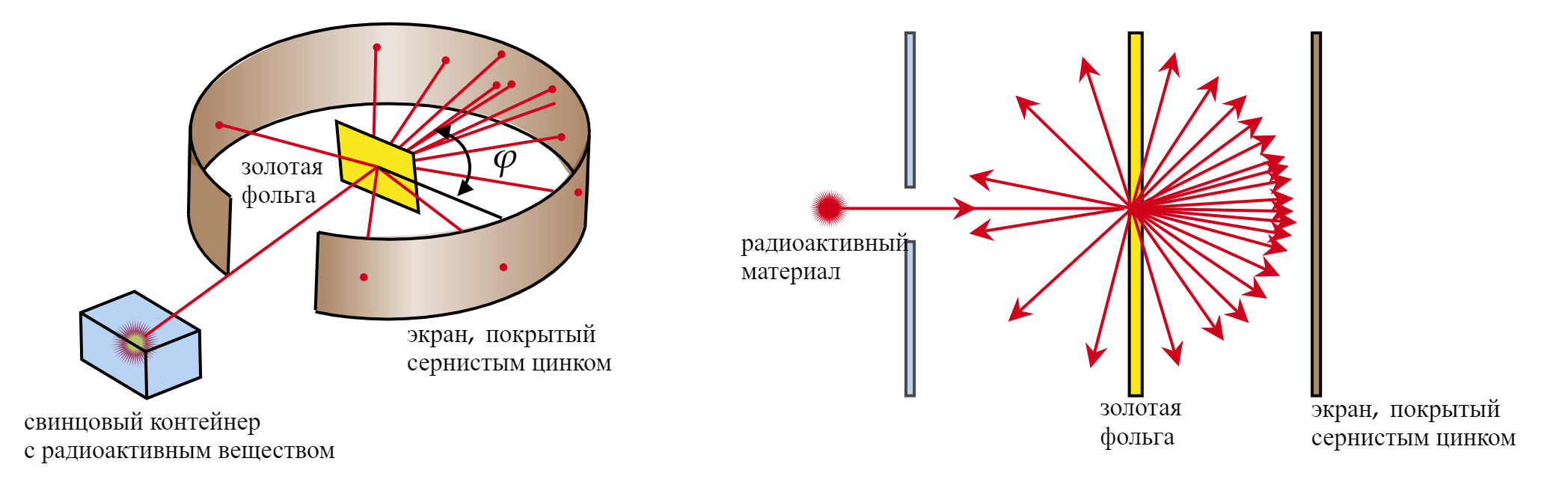
Большинство альфа-частиц рассеивались на углы порядка 3. Отдельные альфа-частицы (одна из нескольких
тысяч) отклонялись на большие углы, до 150
. Такое отклонение возможно лишь при взаимодействии практически
точечного положительного заряда — ядра атома — с близко пролетающей альфа-частицей. Малая вероятность
отклонения на большие углы говорит о малых размерах ядра.
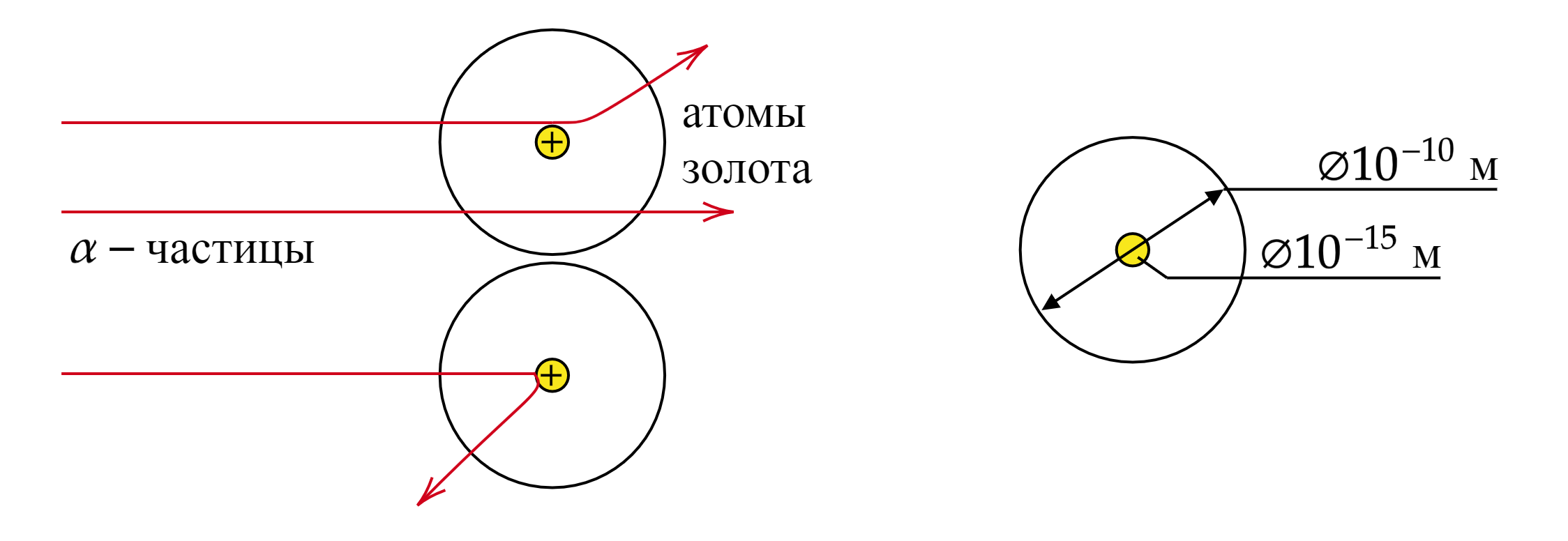
Вывод: модель атома Томсона не «работает». Положительные и отрицательные частицы не расположены в атоме равномерно. Ядро атома не нейтрально. На основании полученных результатов была предложена планетарная модель атома.
Планетарная модель атома: в середине атома существует плотный клубок частиц, то есть в ядре атома находятся положительно заряженные протоны и нейтральные нейтроны. На значительном расстоянии от ядра по орбитам вокруг него обращаются отрицательно заряженные частицы — электроны.
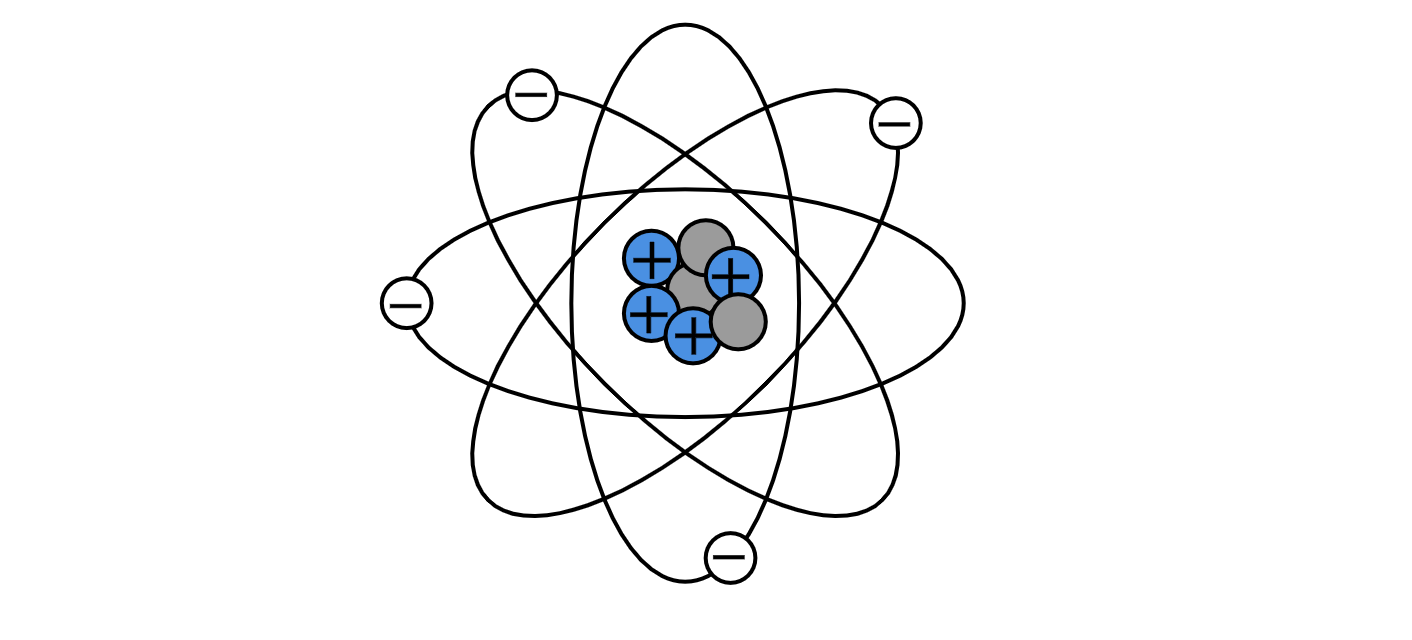
Так как положительный заряд равен по величине отрицательному, то в целом атом электрически нейтрален. Он не несет никакого заряда. Но само ядро — это сосредоточие положительного заряда.
Противоречие: планетарная модель атома была в явном противоречии с классической электродинамикой. Электрон, двигаясь по окружности с нормальным ускорением, должен излучать энергию, следовательно, замедлять скорость и упасть на ядро. Модель Резерфорда не могла объяснить, почему атом устойчив.
Элементарная теория Бора
Нильс Бор сформулировал идею о дискретности энергетических состояний атомов, построил атомную модель, открыв условия устойчивости атомов. Также ученый создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам.
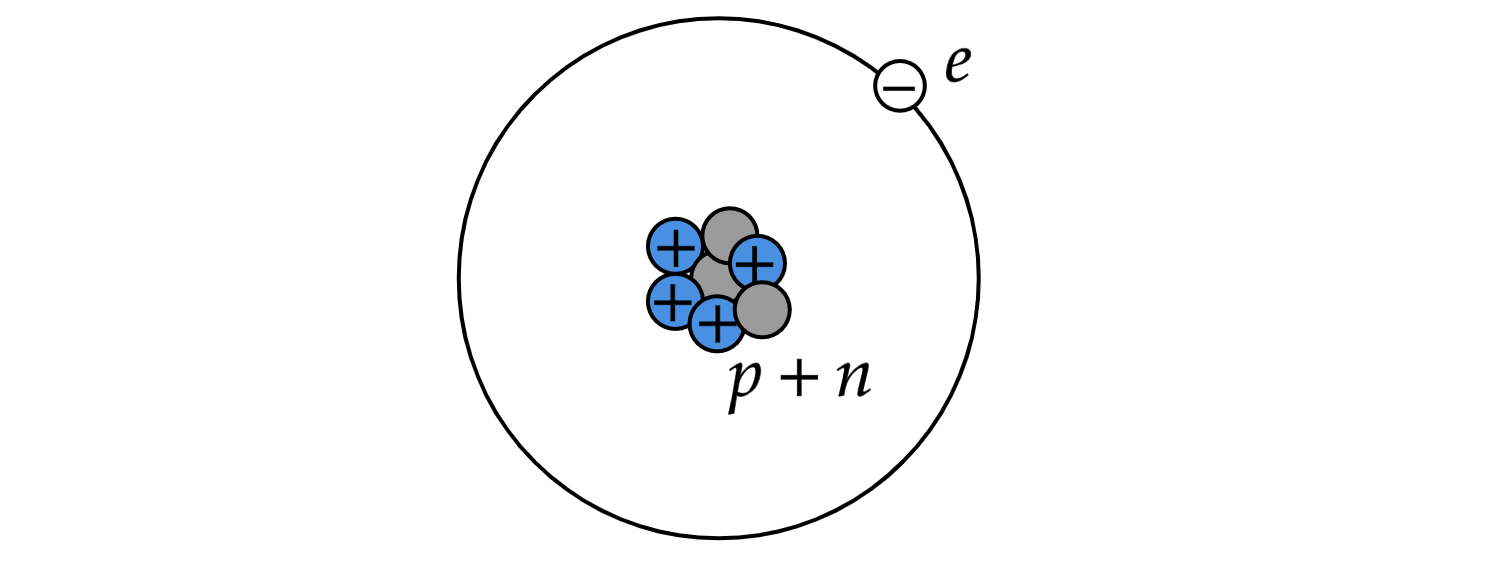
I. Первый постулат Бора: атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая в одном из стационарных состояний, атом не излучает энергии. Другими словами, электроны в атоме движутся только по определенным (стационарным) орбитам, при этом излучения энергии не происходит.
Условие для стационарных орбит: из всех орбит электрона возможны только те, для которых момент импульса электрона равен целому числу, кратному постоянной Планка. То есть момент импульса электрона квантуется.
где — момент импульса электрона,
— натуральные числа (
)
— приведенная постоянная
Планка,
— постоянная Планка.
Квантование в узком смысле — это деление какой-либо физической величины (энергии, момента импульса, электрического заряда и др.) на дискретные порции (кванты), в классической теории эти величины могут иметь только непрерывные значения.
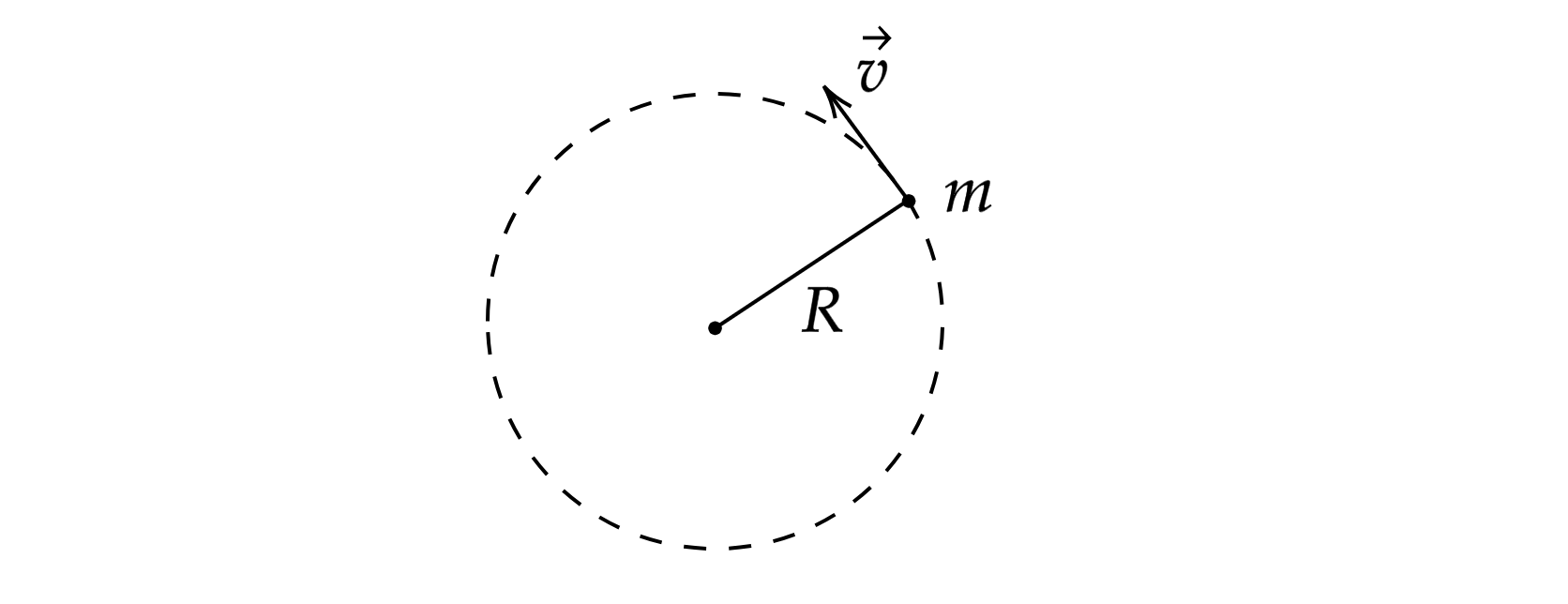
Момент импульса — произведение импульса и плеча
(для аналогии можно вспомнить момент силы
).
«Исторический» вывод I постулата Бора
Рассмотрим первый и самый простой элемент периодической системы химических элементов — водород. Атом
водорода состоит из одного протона и одного электрона. Обозначим за
элементарный заряд
Кл.
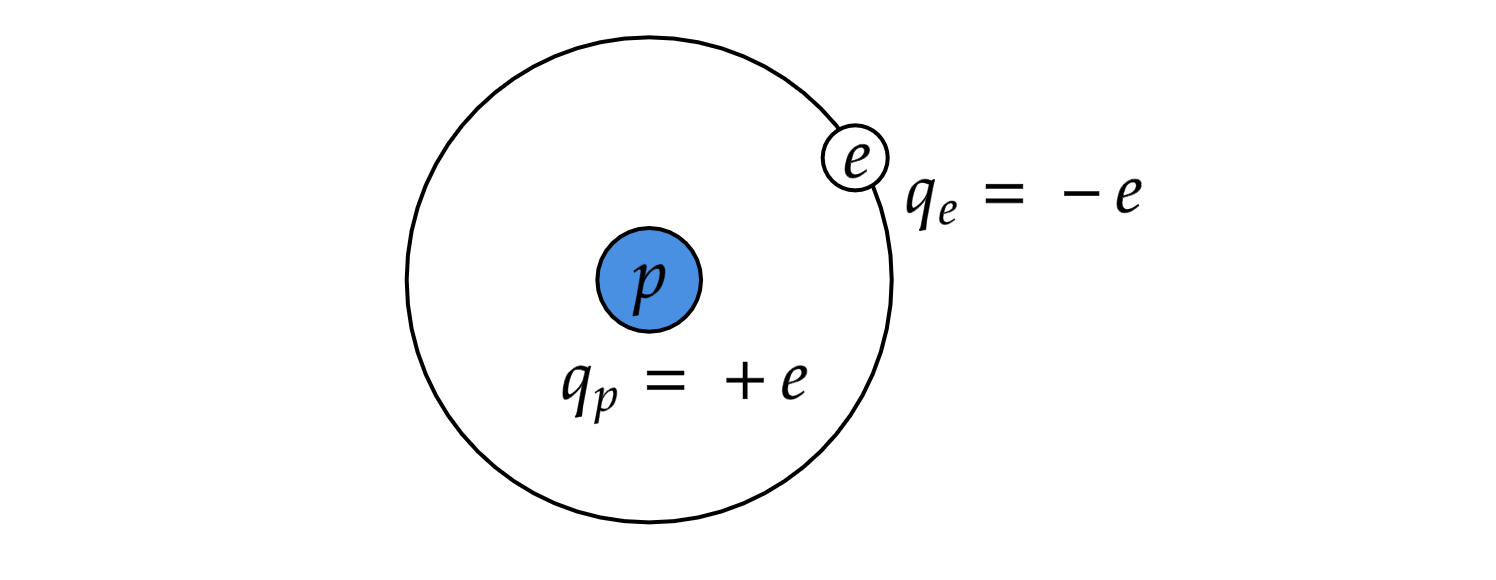
Энергия электрона состоит из кинетической и потенциальной энергии:
Потенциальная энергия взаимодействия двух электрических частиц:
Тогда общая энергия электрона:
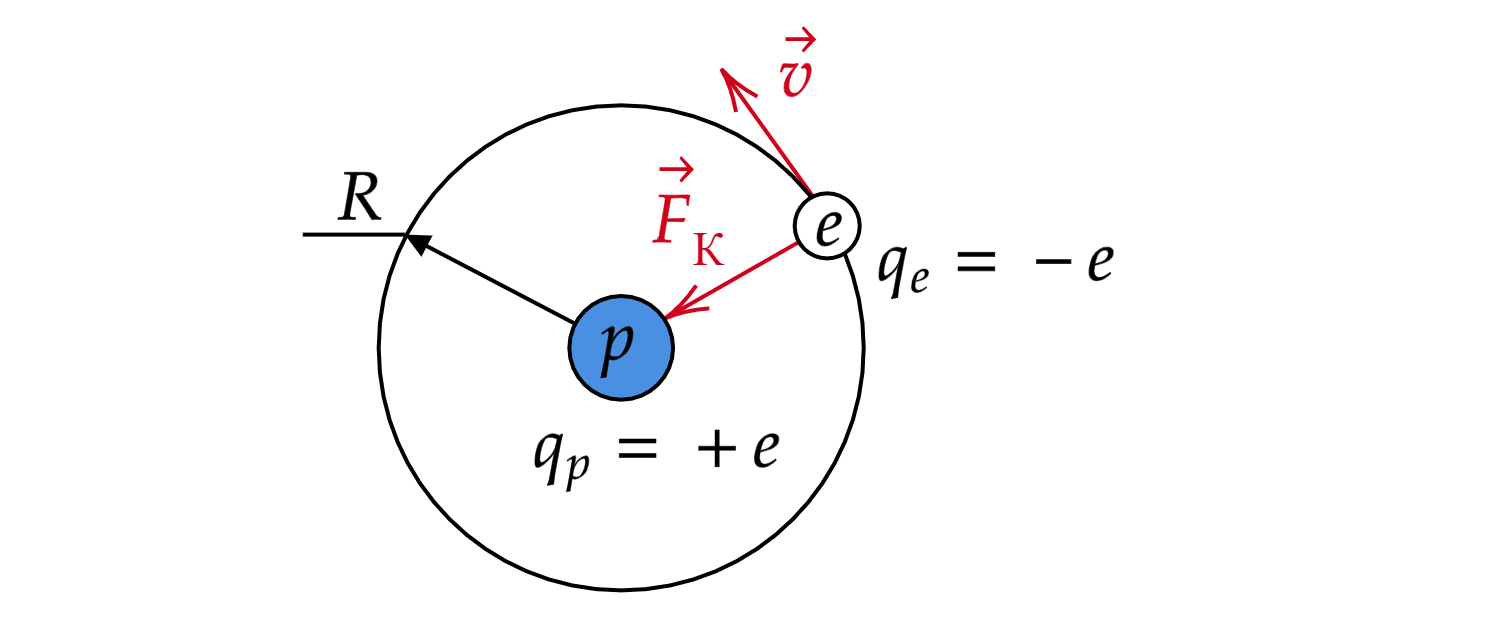
В рамках классической механики на электрон действует сила Кулона , которая создает центростремительное
ускорение
. По второму закону Ньютона:
Силу Кулона по определению можно найти как
Приравняем два последних выражения и выразим величину :
С учетом этого общая энергия электрона равна:
Вспомним правило квантования:
Из приравненных выражений для второго закона Ньютона и силы Кулона выразим скорость:
С учетом этого запишем правило квантования и выразим радиус:
Подставим полученное выражение для радиуса в формулу для полной энергии электрона:
Подставим вместо коэффициентов при их численные значения:
Переведем полученное значение в электронвольты:
1 эВ — это энергия приобретаемая электроном при прохождении им разности потенциалов в 1 В.
Таким образом, получаем следующую зависимость для энергетических уровней атома водорода:
где — номер энергетического уровня.
Электрон может обладать одной из энергий и находиться на соответствующей орбите. Никаких
промежуточных стадий в стабильных атомах быть не может. Энергия излучается или поглощается дискретными
порциями (то есть квантами). Электрон не может излучить или поглотить дробное число фотонов.
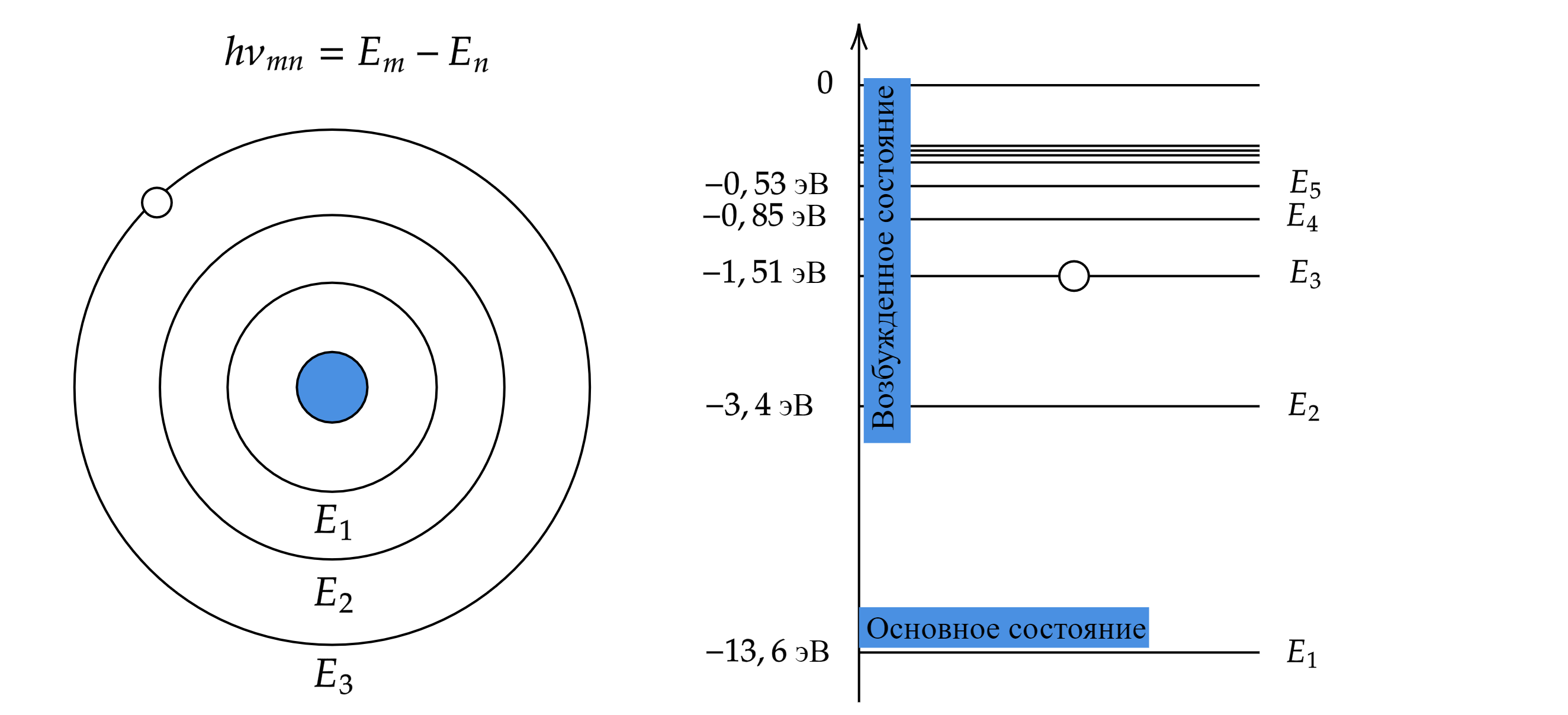
II. Второй постулат Бора: при переходе электрона с одной стационарной орбиты на другую излучается или поглощается один фотон с энергией
Энергия светового кванта равна разности энергий тех станционарных состояний, между которыми совершается квантовый скачок электрона.
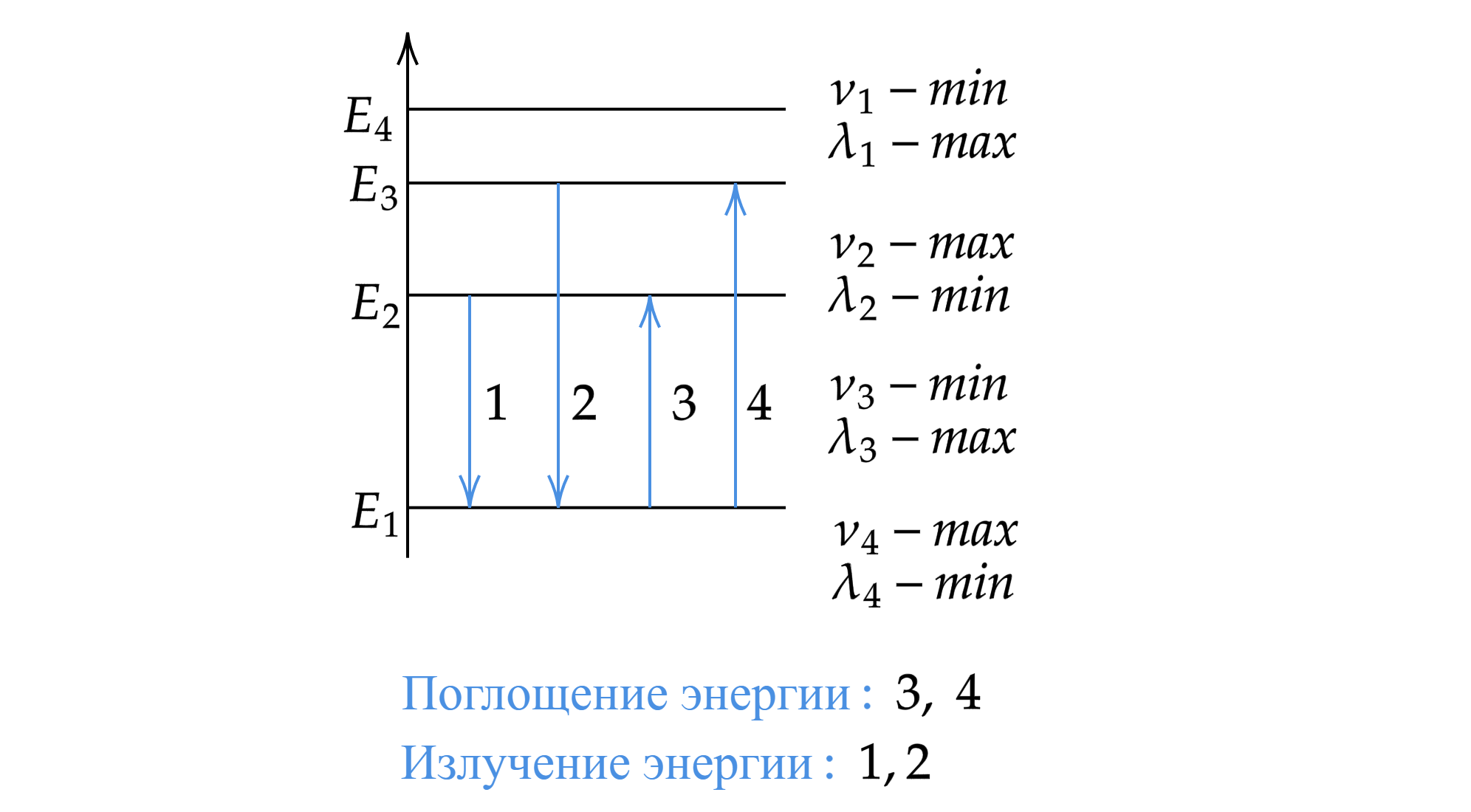
Отсюда появляются спектры излучения и поглощения — набор электромагнитных частот, которые атом может излучать или поглощать соответственно. Благодаря спектрам излучения и поглощения можно идентифицировать каждый химический элемент.

Недостатки теории Бора
— Внутренняя противоречивость: механическое соединение классической физики с квантовыми постулатами.
— Абсолютная невозможность применить теорию для объяснения спектров хотя бы атома гелия (два
электрона на орбите — и уже теория Бора не справляется). Даже для молекулы водорода
она не
применима.
Теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией стала квантовая механика.
Для задач*
Если в задаче нужно посчитать аналитически уровни для водородоподобного атома (атом, вокруг которого вращается лишь один электрон), то можно повторить ту же самую идею с расчетами и получить необходимую формулу.
Все уравнения, которые были ранее записаны для атома водорода, остаются справедливыми. Единственным
отличием по сравнению с атомом водорода является то, что сила кулоновского взаимодействия валентного электрона с
ядром водородоподобного атома равна Следовательно, мы можем воспользоваться готовым
результатом для энергии
электрона на
-й стационарной орбите, если заменим в ранее выведенной формуле
на
В результате получим:
