Тепловые явления
Готовиться с нами - ЛЕГКО!
Теоретическая справка
#599
Фазовый переход — переход из одного агрегатного состояния в другое.
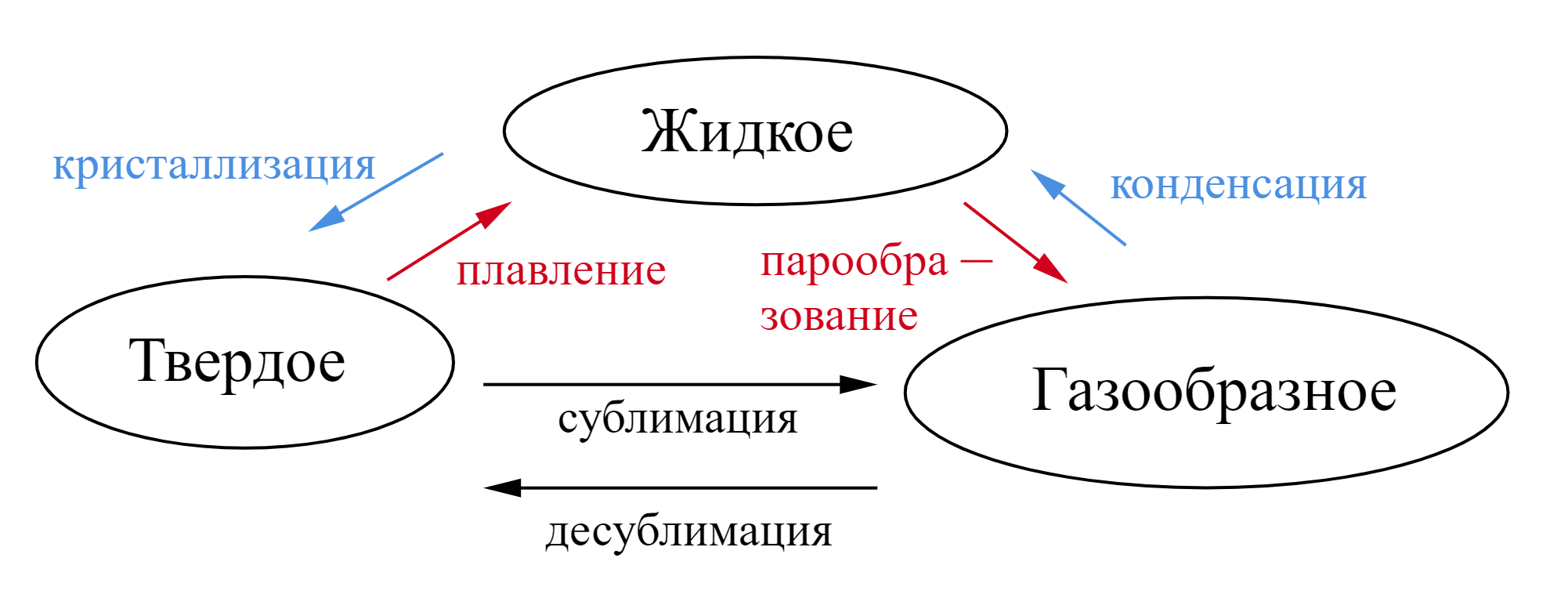
В школьном курсе основное внимание уделяется четырем фазовым переходам:
- Плавление — переход вещества из твердого состояния в жидкое.
- Кристаллизация (процесс, обратный плавлению) — переход вещества из жидкого состояния в твердое.
- Парообразование, или кипение — переход вещества из жидкого состояния в газообразное.
- Конденсация (процесс, обратный парообразованию) — переход вещества из газообразного состояния в жидкое.
Процессы плавления, кипения, конденсации, кристаллизации происходят при постоянной температуре.
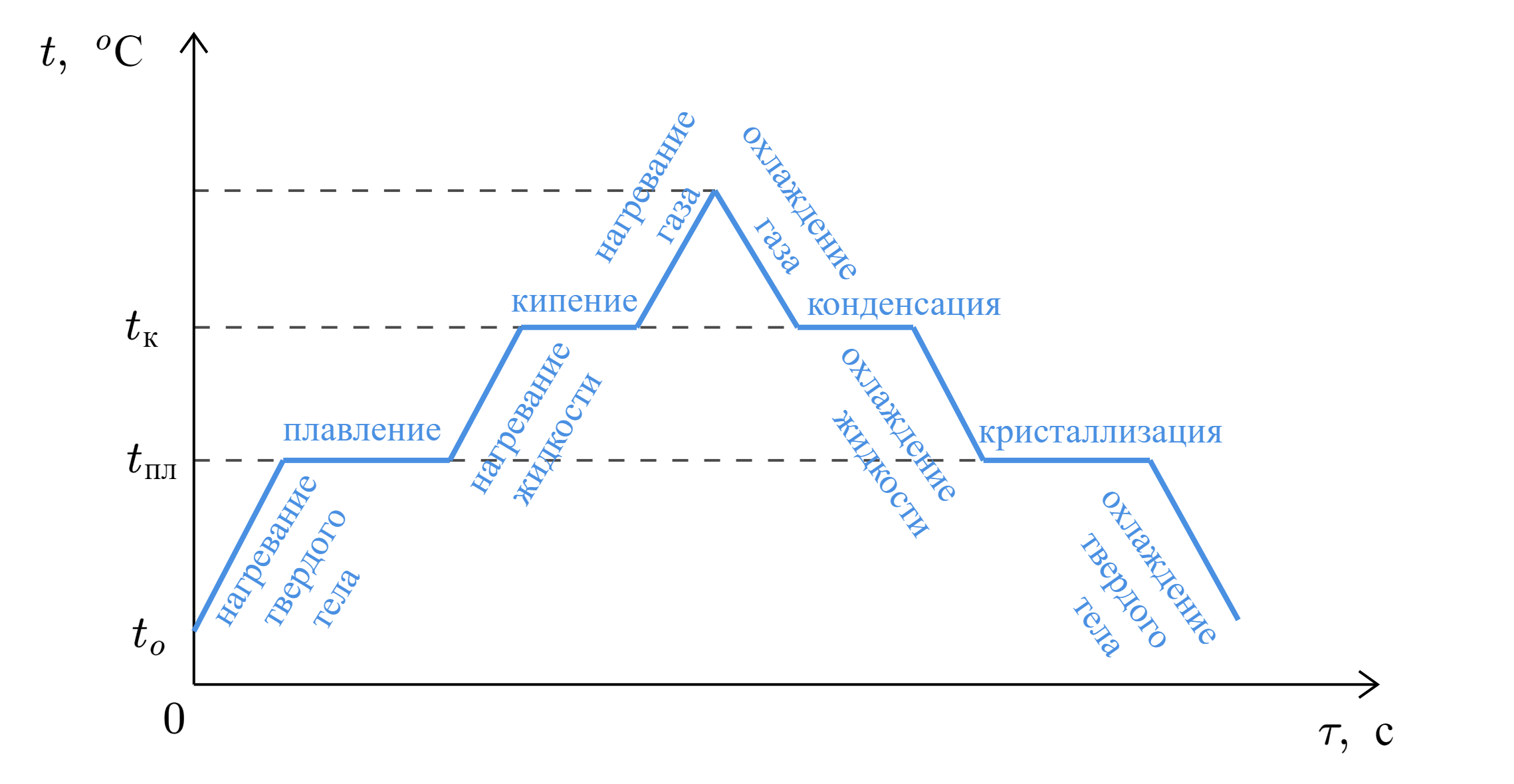
1. Количество теплоты, необходимое для нагрева/охлаждения:
где — масса,
— удельная теплоемкость.
2. Количество теплоты, необходимое для плавления/кристаллизации:
где — удельная теплота плавления. Удельная теплота плавления — табличная величина.
3. Количество теплоты, необходимое для парообразования/конденсации:
где — удельная теплота парообразования. Удельная теплота парообразования — табличная величина.
4. Количество теплоты, необходимое для сгорания топлива:
где — удельная теплота сгорания топлива.
Уравнение теплового баланса
Рассмотрим два тела (обозначим их 1 и 2), которые образуют замкнутую систему. Это означает, что данные тела могут обмениваться энергией только друг с другом, но не с другими телами. Считаем также, что механическая работа не совершается — внутренняя энергия тел меняется только в процессе теплообмена.
Имеется фундаментальный закон природы, подтверждаемый всевозможными экспериментами, — закон сохранения энергии. Он гласит, что полная энергия замкнутой системы тел не меняется со временем.
В данном случае закон сохранения энергии утверждает, что внутренняя энергия нашей системы будет оставаться
одной и той же: Если изменение внутренней энергии первого тела равно
, а изменение
внутренней энергии второго тела равно
, то суммарное изменение внутренней энергии будет равно
нулю:
Но — количество теплоты, полученное первым телом в процессе теплообмена; аналогично
—
количество теплоты, полученное вторым телом в процессе теплообмена. Стало быть,
Полученное соотношение называется уравнением теплового баланса. В общем случае, когда тел образуют
замкнутую систему и обмениваются энергией только с помощью теплопередачи, из закона сохранения энергии с
помощью тех же рассуждений получаем общее уравнение теплового баланса:
