Термодинамика процесса. Термодинамика цикла
Готовиться с нами - ЛЕГКО!
Теоретическая справка
#598
Внутренняя энергия газа
Кинетическая энергия поступательного движения молекулы:
Внутренняя энергия есть сумма всех кинетических и потенциальных энергий молекулы:
Модель идеального газа подразумевает, что молекулы газа не взаимодействуют друг с другом, поэтому вторым
слагаемым можно пренебречь (устремить его к нулю):
где — число молекул (вводится, чтобы избавиться от значка суммы
).
Распишем кинетическую энергию как энергию поступательного движения молекулы:
Число молекул определим из формулы для количества вещества:
Тогда внутренняя энергия газа определяется как:
Произведение двух постоянных (числа Авогадро и постоянной Больцмана
) для удобства обозначим новой
константой
— универсальной газовой постоянной.
Тогда внутренняя энергия газа:
Единицы измерения:
Дж — джоуль.
Вспомнив уравнение Менделеева-Клапейрона, внутреннюю энергию газа можно представить в виде:
Выведенные в данном пункте формулы справедливы для модели одноатомного идеального газа.
В общем виде внутренняя энергия идеального газа определяется как:
где — число степеней свободы.
Число степеней свободы
Число степеней свободы — это количество независимых переменных, однозначно определяющих положение тела в пространстве.
Примеры одноатомных газов: гелий , аргон
, неон
и другие инертные газы; двухатомных газов:
водород
, кислород
, азот
; трехатомных газов: водяной пар
, озон
.
Изменение внутренней энергии газа
Формулы в данном пункте справедливы для модели одноатомного идеального газа.
При условии, что количество вещества остается постоянным, изменение внутренней энергии:
где — разность конечной и начальной температуры.
Вспомнив уравнение Менделеева-Клапейрона, изменение внутренней энергии газа можно представить в виде:
Работа газа
Пусть под поршнем площадью находится идеальный газ. Газ, действуя на поршень с некоторой силой
,
заставляет его переместиться вверх на величину
.
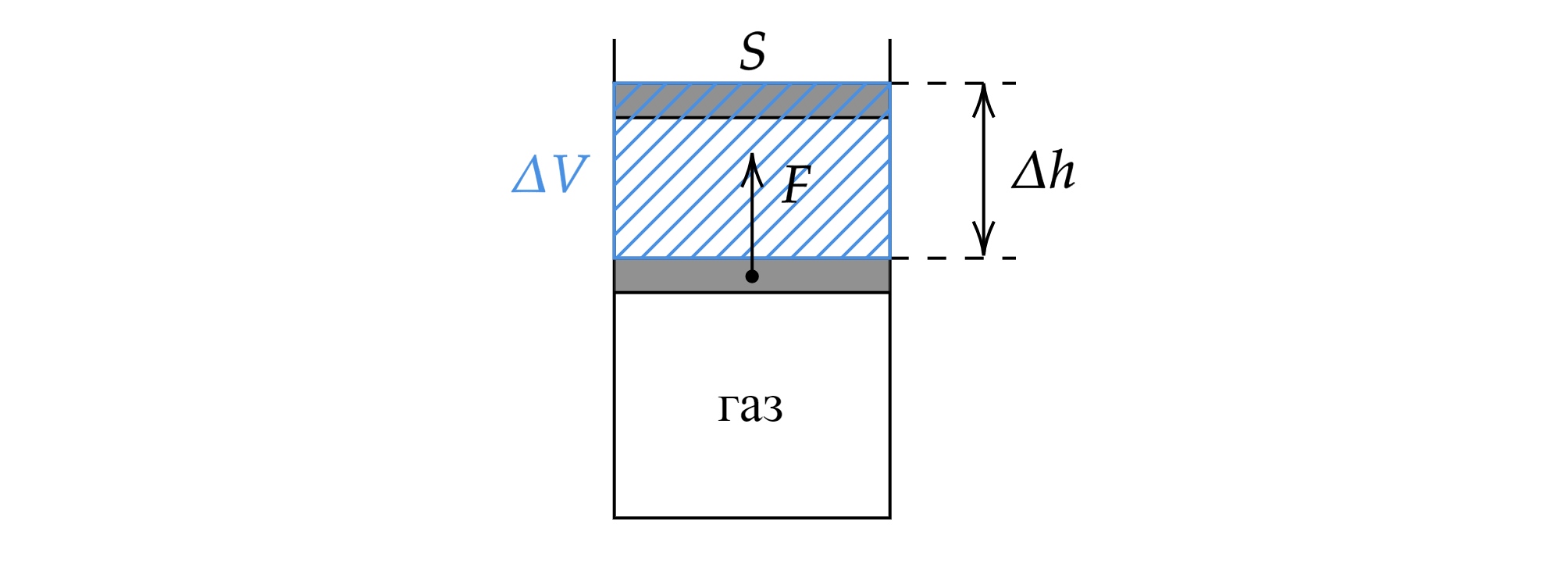
По определению, работа есть произведение силы на перемещение (угол между векторами перемещения и силы равен
, а
):
Примем за малое перемещение. В рамках малого перемещения давление
можно считать неизменным, то
есть процесс происходит изобарно. Из этого следует, что сила
является постоянной, так как, исходя из формулы
, сила зависит от площади и давления. С учетом этого:
Выражение есть не что иное, как изменение объема
. Таким образом, работа газа при постоянном
давлении:
Единицы измерения:
Дж — джоуль.
Мы рассмотрели лишь частный случай работы газа (при постоянном давлении) для общего понимания. Теперь приведем все случаи, включая те, когда давление газа не постоянно, то есть процесс не изобарный.
Способы определения работы газа:
1. При изобарном процессе ()
2. Работа численно равна площади под графиком в
-координатах.
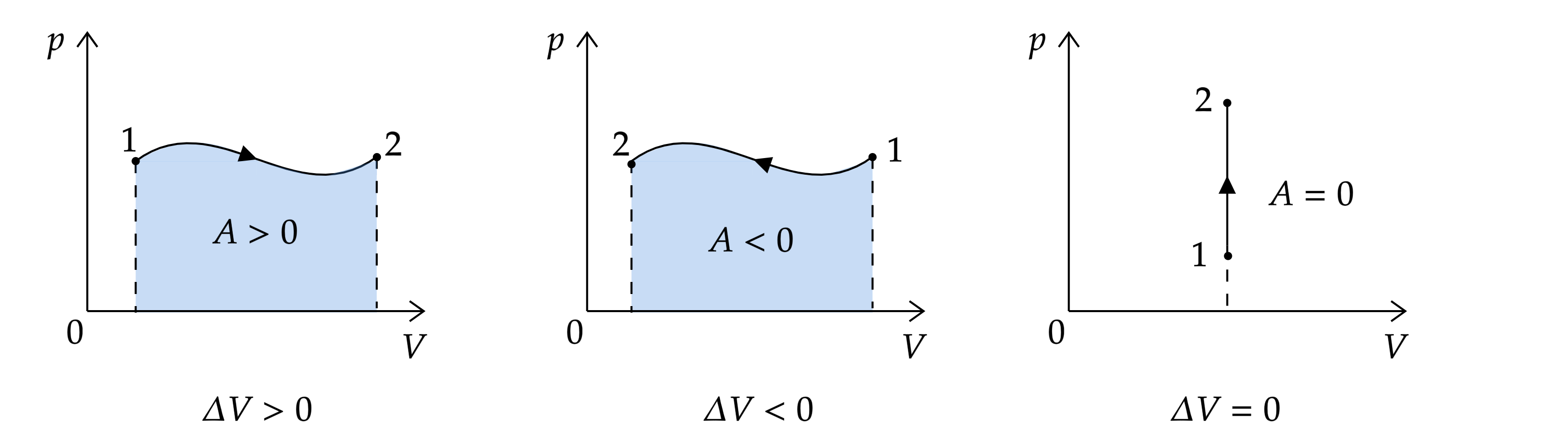
Обратите внимание, что это справедливо только для графиков в -координатах.
3. При непостоянном давлении работа находится как интеграл вида:
Работа над газом
Запишем закон изменения кинетической энергии для рассмотренного выше поршня: изменение кинетической энергии поршня равно сумме работ всех сил, действующих на поршень. На поршень действует газ и некоторые внешние силы.
Как правило, в термодинамике рассматриваются квазистатические процессы. Квазистатический процесс — это бесконечно медленный переход термодинамической системы из одного равновесного состояния в другое, при котором в любой момент времени физическое состояние системы бесконечно мало отличается от равновесного.
Так как рассматриваются такие процессы, когда система всегда приходит в равновесие, то изменением кинетической энергии поршня можно пренебречь (устремить к нулю). Тогда работа газа:
Первое начало термодинамики
Понятие количества теплоты вводится в первом начале (или законе) термодинамики.
Формулировка: количество теплоты, переданное газу, идет на изменение внутренней энергии газа и на совершение газом работы.
где — количество теплоты,
— изменение внутренней энергии,
— работа газа.
Единицы измерения:
Дж — джоуль.
Чтобы верно записать первый закон термодинамики в том или ином случае, необходимо знать знак каждой из трех
величин. Для того чтобы определить знак изменения энергии и работы газа
, достаточно проанализировать
следующие формулы:
Составим на основе этого таблицу.
Применение первого закона термодинамики к изопроцессам
-
Изотермический процесс,
,
Все подведенное к газу тепло идет на совершение газом работы.
-
Изохорный процесс,
,
Все тепло, переданное газу, идет на изменение его внутренней энергии.
-
Изобарный процесс,
Адиабатический процесс
Процесс называется адиабатным (или адиабатическим), если он идет без теплообмена с окружающими телами.
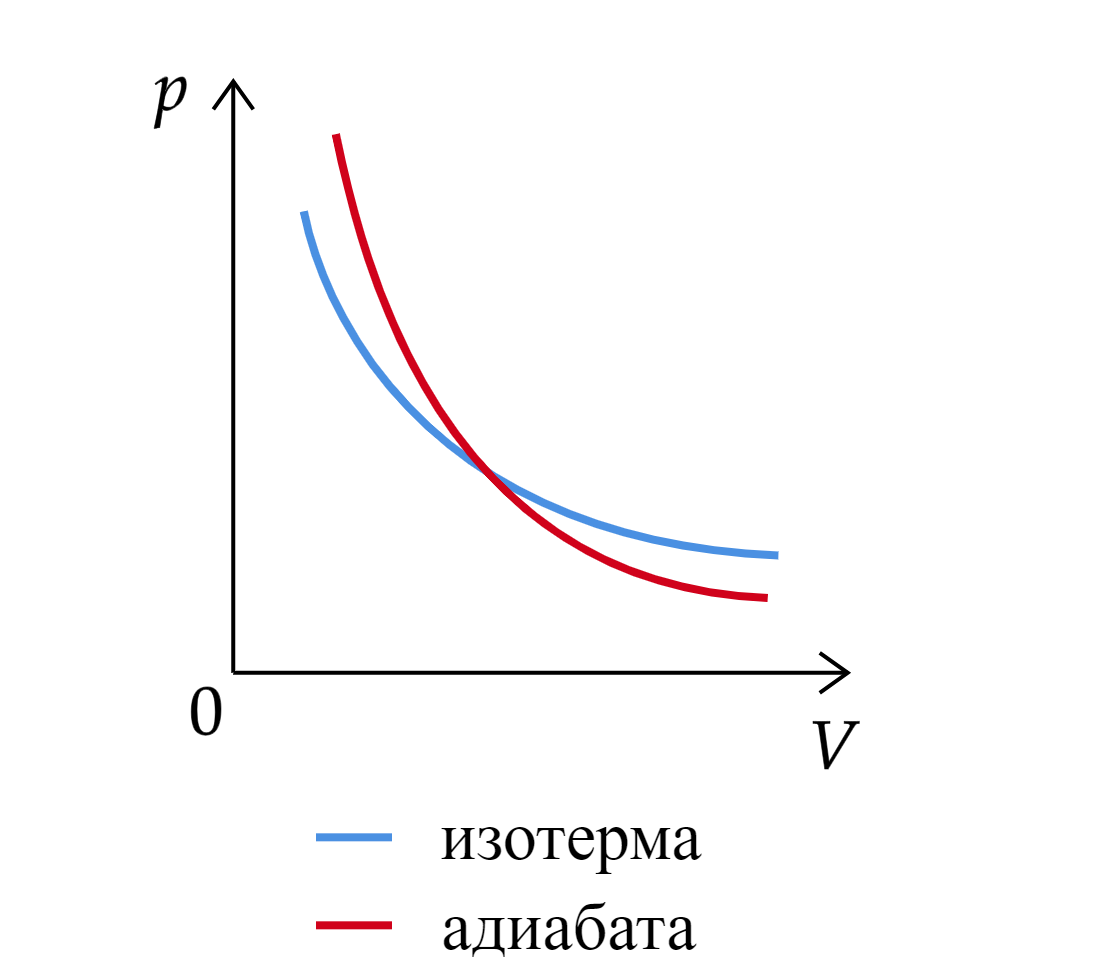
При адиабатном процессе . Кривая, изображающая ход адиабатного процесса, называется адиабатой.
Тепловая машина
Тепловая машина (двигатель) — это циклически действующее устройство, превращающее теплоту в работу.
Принципиальная схема тепловой машины состоит из следующих элементов.
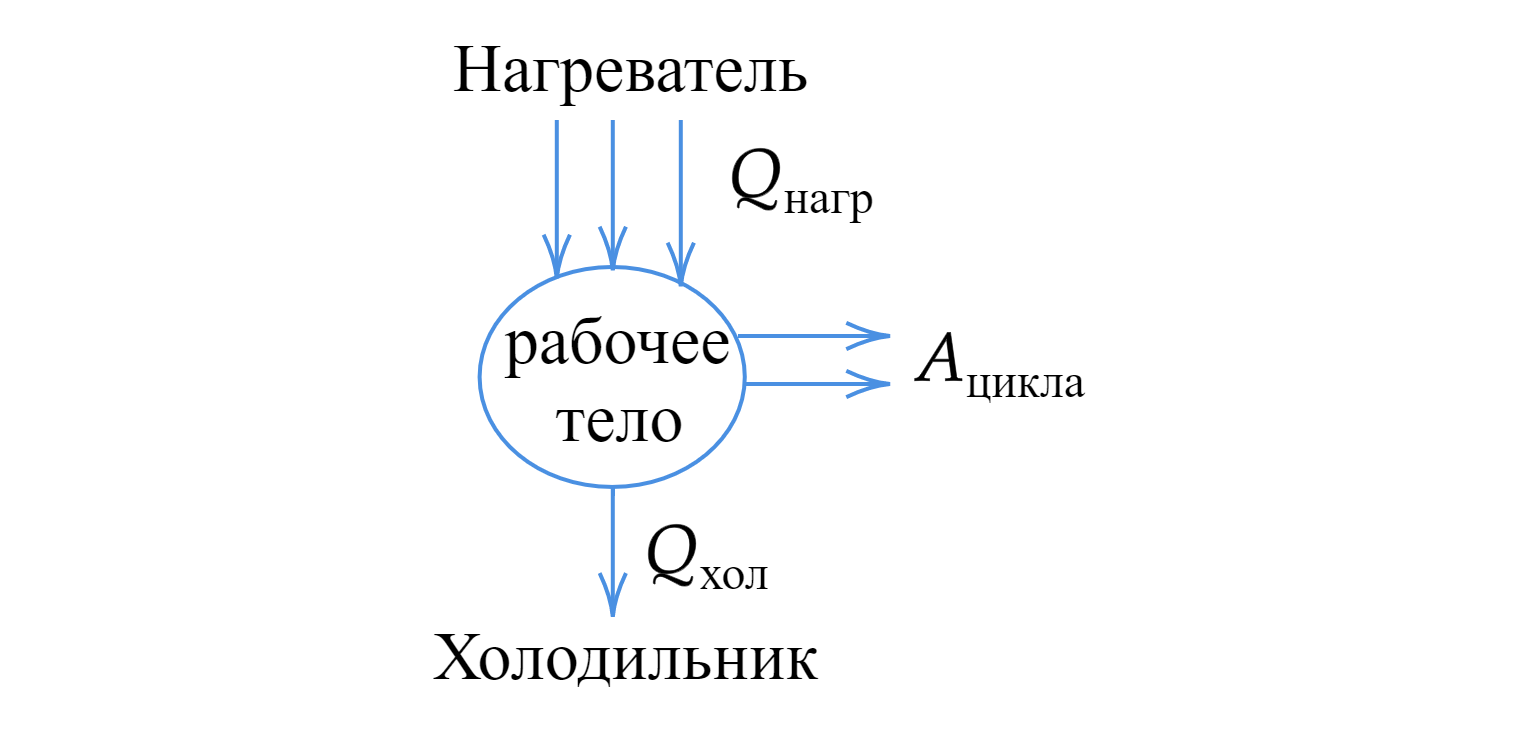
Рабочее тело двигателя — это газ. Он расширяется, двигает поршень и совершает тем самым полезную механическую работу.
Чтобы заставить газ расширяться, преодолевая внешние силы, нужно нагреть его до температуры, которая существенно выше температуры окружающей среды. Для этого газ приводится в контакт с нагревателем.
В процессе нагревания выделяется значительная энергия, часть которой идёт на нагревание газа. Газ получает от
нагревателя количество теплоты . Именно за счёт этого тепла двигатель совершает полезную работу
.
Чтобы вернуть систему в исходное состояние, необходимо отвести часть энергии, то есть «отдать» ее холодильнику.
Часть количества теплоты, которое было сообщено телу, тратится на совершение самой работы, а другая часть энергии отдается холодильнику. Закон сохранения энергии:
Тогда работа цикла равна:

Коэффициент полезного действия
Коэффициент полезного действия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии.
КПД определяется отношением полезной работы, совершенной механизмом, ко всей затраченной работе (подведенной энергии) за то же время.
Единицы измерения:
КПД является безразмерной величиной и не может быть больше 1 или 100%.
— проценты.
доли единицы.
КПД для тепловой машины:
Из закона сохранения энергии , тогда КПД тепловой машины можно записать следующим
образом:
Цикл Карно
В термодинамике цикл Карно — это идеальный циклический процесс, состоящий из двух адиабатных и двух изотермических процессов.
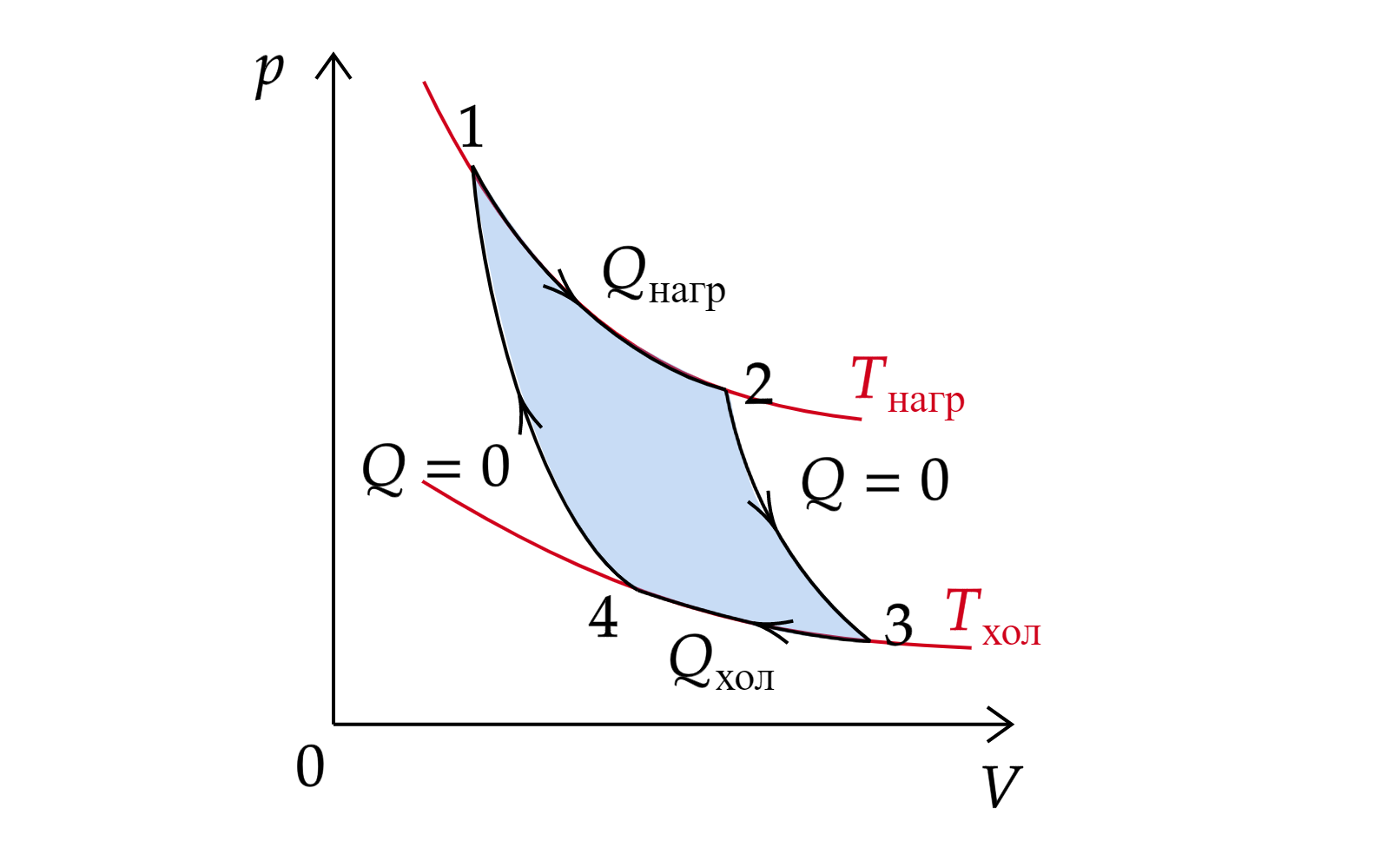
1-2 изотермическое расширение ();
2-3 адиабатическое расширение ();
3-4 изотермическое сжатие ();
4-1 адиабатическое сжатие ().
Тепловая машина, работающая по циклу Карно, называется идеальной.
КПД цикла Карно:
