Постулаты бора. Спектры излучения и поглощения
Готовиться с нами - ЛЕГКО!
Теоретическая справка
#969
Предыстория: модель атома Томсона
Первую модель атома предложил Джозеф Джон Томсон в 1904 году.
Модель «пудинга»/«булочки с изюмом»/«кекса»: сфера, равномерно заполненная положительным электричеством, внутри которой находятся электроны. Суммарный заряд этой сферы равен заряду электронов, атом в целом нейтрален.
Идея: существуют твердые тела, следовательно, атом должен быть чем-то заполнен. Данная идея выглядела правдоподобно.
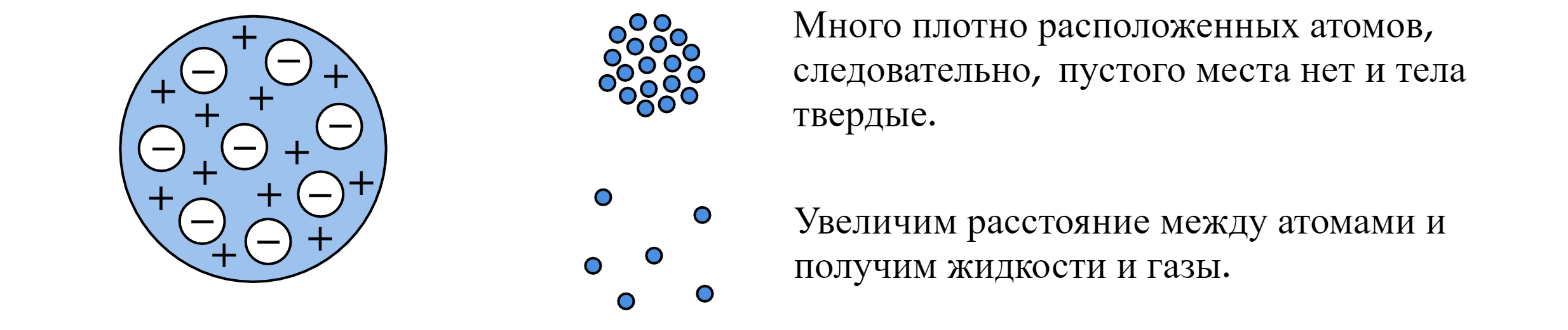
Противоречие: согласно модели Томсона спектр атома должен быть сложным, но никак не линейчатым. Это противоречило экспериментам. Теория строения атома по Томсону была опровергнута экспериментами, проведенными Эрнестом Резерфордом в 1911 году.
Модель атома Резерфорда
На момент экспериментов Резерфорда ученым уже было известно о существовании радиоактивных элементов, законах радиоактивного распада и о трех основных типах распада (альфа-, бета- и гамма-распады), при этом было также известно, что альфа-распад имеет самые тяжелые частицы — ядра гелия.
Резерфорд предположил, что, если направить поток альфа-частиц на тонкую золотую фольгу, состоящую согласно модели атома Томсона из плотно расположенных атомов, то альфа-частицы в теории не должны пройти сквозь нее.

Проведя эксперимент, Резерфорд получил, что рассеянные альфа-частицы ударялись об экран, покрытый сернистым цинком, и вызывали вспышки света.
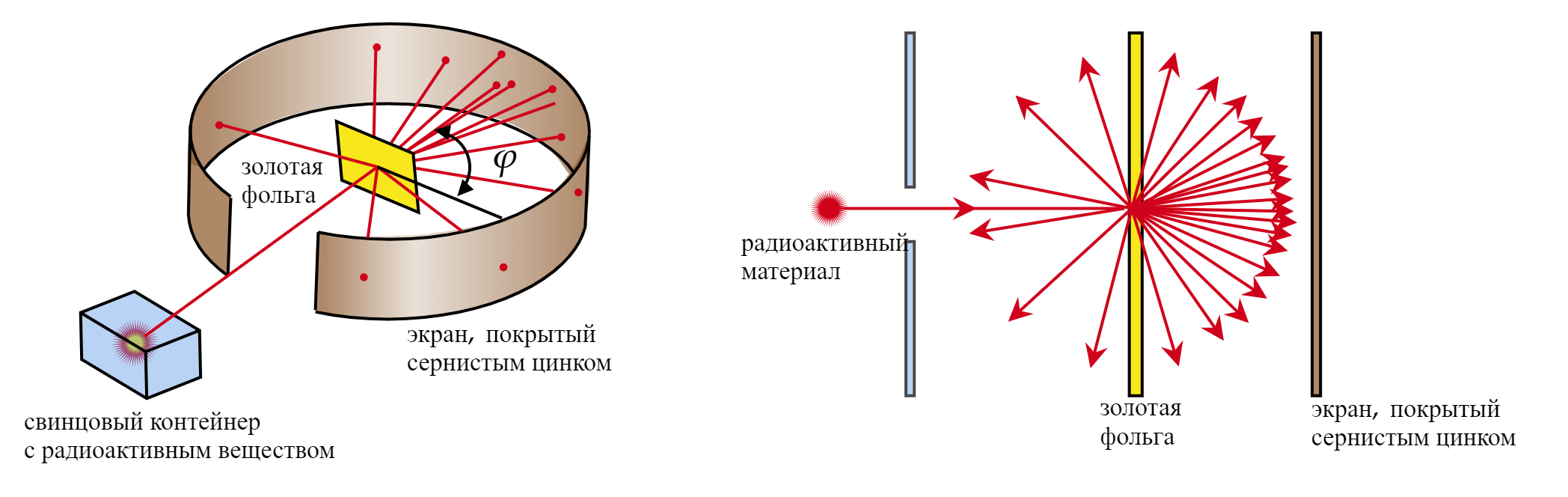
Большинство альфа-частиц рассеивались на углы порядка 3. Отдельные альфа-частицы (одна из нескольких
тысяч) отклонялись на большие углы, до 150
. Такое отклонение возможно лишь при взаимодействии практически
точечного положительного заряда — ядра атома — с близко пролетающей альфа-частицей. Малая вероятность
отклонения на большие углы говорит о малых размерах ядра.
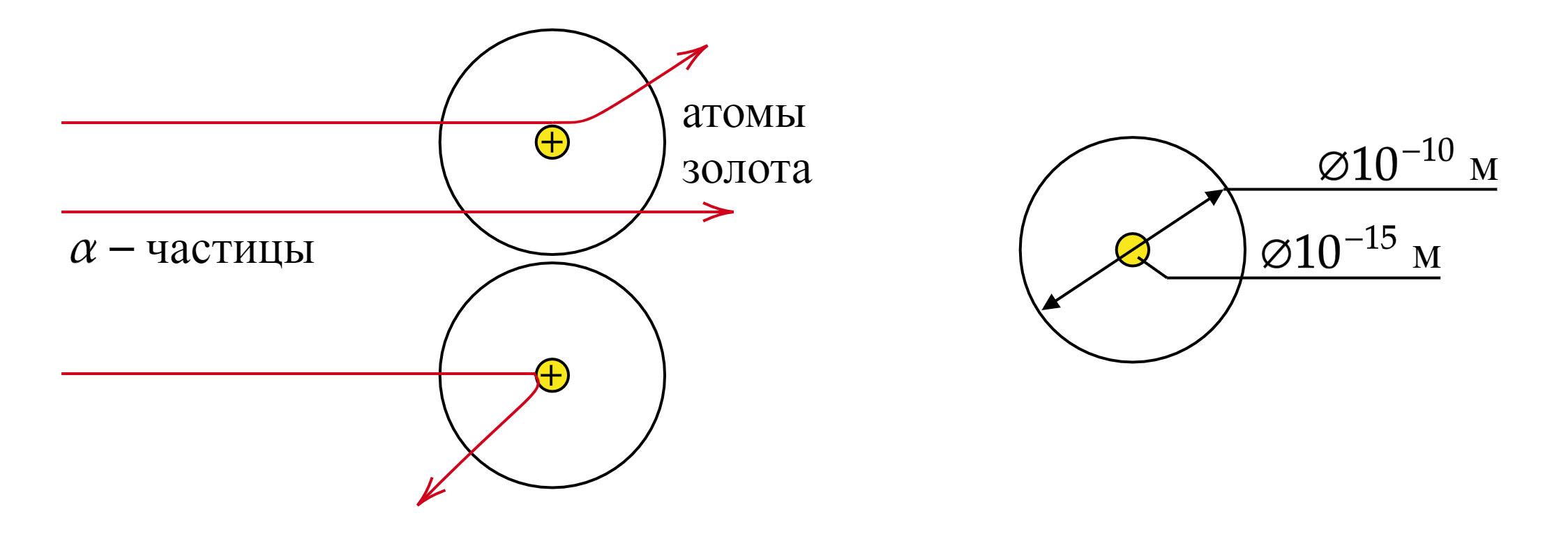
Вывод: модель атома Томсона не «работает». Положительные и отрицательные частицы не расположены в атоме равномерно. Ядро атома не нейтрально. На основании полученных результатов была предложена планетарная модель атома.
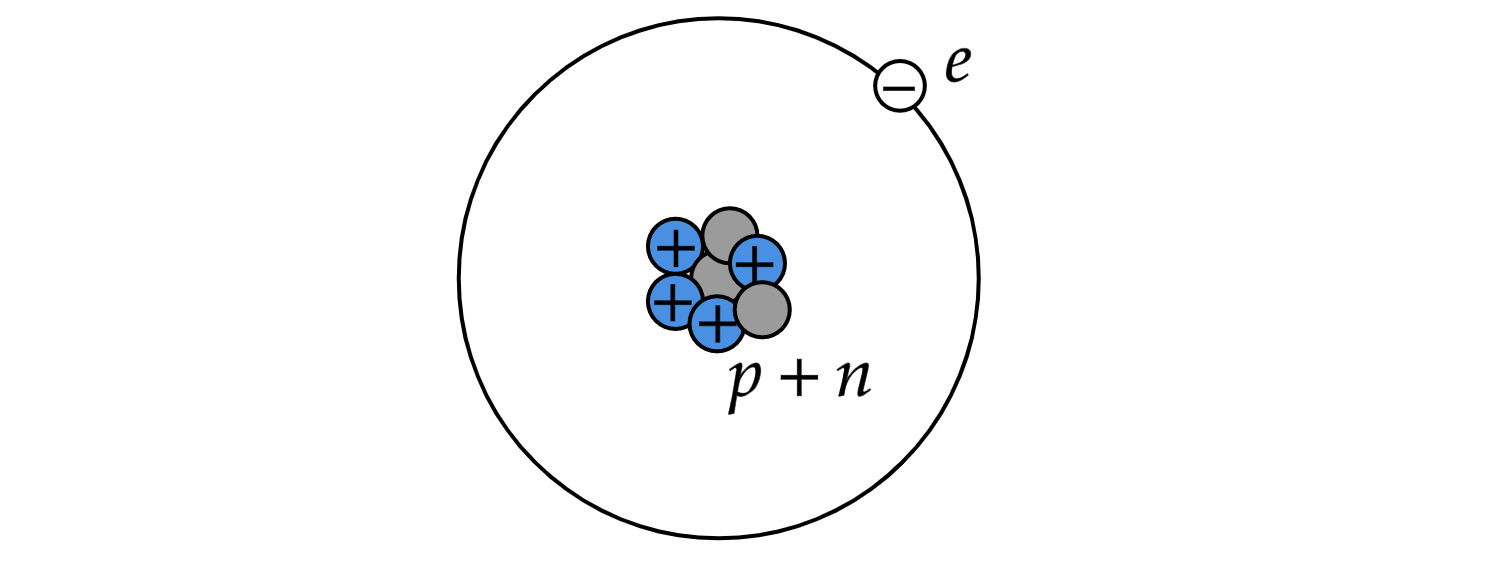
Планетарная модель атома: в середине атома существует плотный клубок частиц, то есть в ядре атома находятся положительно заряженные протоны и нейтральные нейтроны. На значительном расстоянии от ядра по орбитам вокруг него обращаются отрицательно заряженные частицы — электроны.
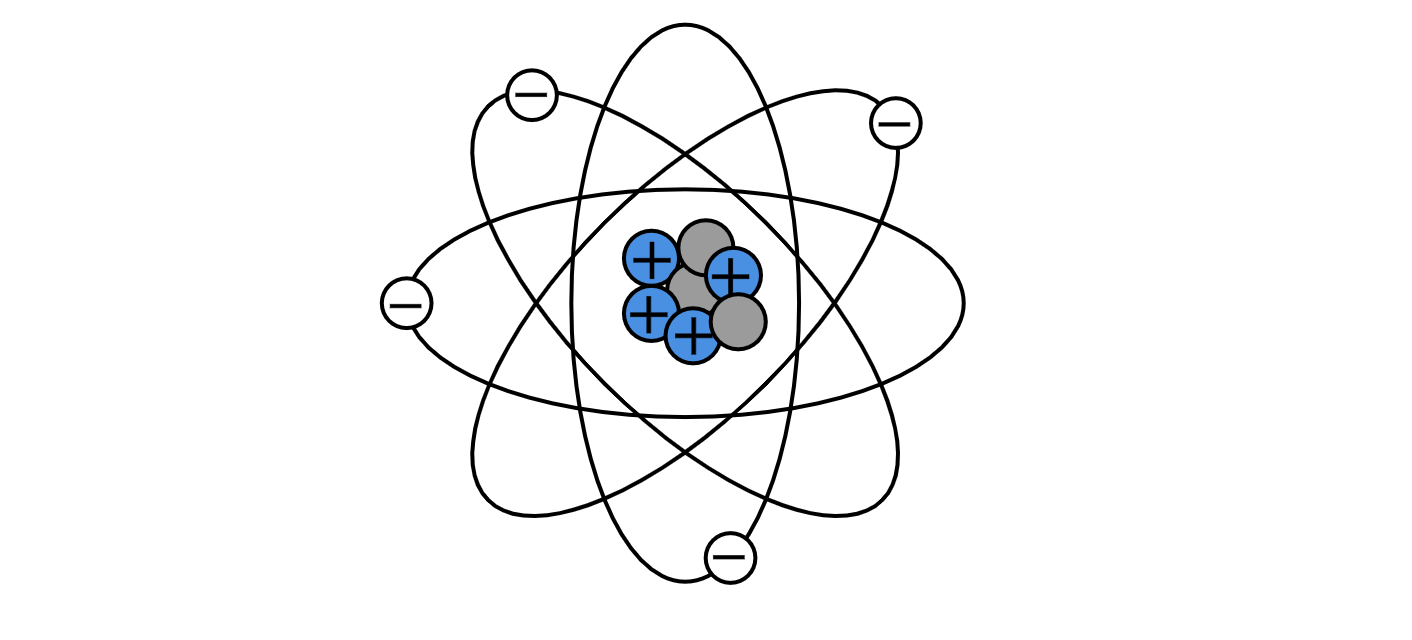
Так как положительный заряд равен по величине отрицательному, то в целом атом электрически нейтрален. Он не несет никакого заряда. Но само ядро — это сосредоточие положительного заряда.
Противоречие: планетарная модель атома была в явном противоречии с классической электродинамикой. Электрон, двигаясь по окружности с нормальным ускорением, должен излучать энергию, следовательно, замедлять скорость и упасть на ядро. Модель Резерфорда не могла объяснить, почему атом устойчив.
Элементарная теория Бора
Нильс Бор сформулировал идею о дискретности энергетических состояний атомов, построил атомную модель, открыв условия устойчивости атомов. Также ученый создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам.