Молекулярная физика (страница 3)
Готовиться с нами - ЛЕГКО!

Постоянное количество одноатомного идеального газа участвует в процессе, график которого изображён на рисунке в координатах \(р—n\), где \(р\) – давление газа, \(n\) – его концентрация. Определите, получает газ теплоту или отдаёт в процессах 1–2 и 2–3. Ответ поясните, опираясь на законы молекулярной физики и термодинамики. 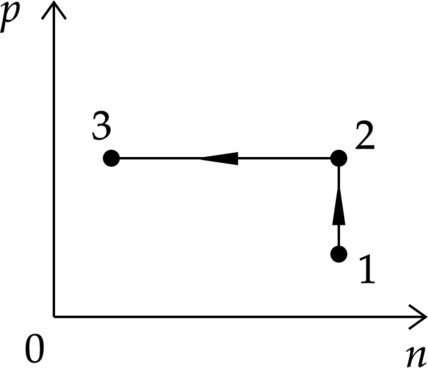
1. По первому закону термодинамики \[Q=\Delta U+A, \quad (1)\] где \(\Delta U\) – изменение внутренней энергии, \(A\) – работа газа.
Внутренняя энергия равна \[U=\dfrac{3}{2}\nu R T,\quad (2)\] где \(\nu\) – количество газа, \(T\) – температура газа.
А давление можно найти по формуле: \[p=nkT \quad (3)\] 2. Процесс 1–2.
Концентрация постоянна, давление увеличивается, значит, и температура увеличивается (формула (3)). По объединенному газовому закону \(\dfrac{pV}{T}=const\) объем будет постоянен. Так как объем постоянен, то работа газа равна 0, а из-за увеличения температуры увеличивается и внутренняя энергия, значит, газ получает некоторое количество теплоты.
Процесс 2–3
Давление постоянно, концентрация уменьшается, по формуле (3) температура увеличивается, значит, увеличивается и внутренняя энергия. По объединенному газовому закону \(\dfrac{pV}{T}=const\) объем будет увеличиваться, значит, работа газа положительна. По формуле (1 ) \(Q>0\).

